주요 차이 - 불소 나트륨 대 불화 칼슘
불소는 불소 이온을 함유하는 화합물입니다 (f). 불화 나트륨 및 불소 칼슘은 이러한 두 가지 화합물이다. 불소 나트륨 (NAF)은 나트륨 양이온 및 불소 음이온으로 구성됩니다. 낮은 불소 흡수로 인한 충치를 방지하는 데 사용되는 약물입니다. 또한 식수의 불소 함량이 낮은 지역에서 어린이를 치료하는 데 사용됩니다. 불화 칼슘은 칼슘 양이온 및 불소 음이온으로 구성됩니다. 그것은 불소라는 자연적으로 발생하는 미네랄의 형태로 존재합니다. 불소 나트륨과 불화 칼슘의 주요 차이점은 불소 나트륨 나트륨이 하나의 불소 음이온과 관련하여 하나의 나트륨 양이온을 함유하는 반면, 불소 칼슘은 2 개의 불소 음이온과 관련하여 하나의 칼슘 양이온을 함유한다는 것입니다. .
주요 영역을 다루었습니다
1. 불소 나트륨이란 무엇입니까
- 정의, 화학적 특성, 생산, 사용
2. 불소 칼슘이란 무엇입니까
- 정의, 화학적 특성, 생산, 사용
3. 불소 나트륨과 불소 칼슘의 차이점
- 주요 차이점 비교
주요 용어 :CAF 2 , 칼슘, 불소, 불소, NAF, 나트륨, 나트륨 불소
불소 나트륨
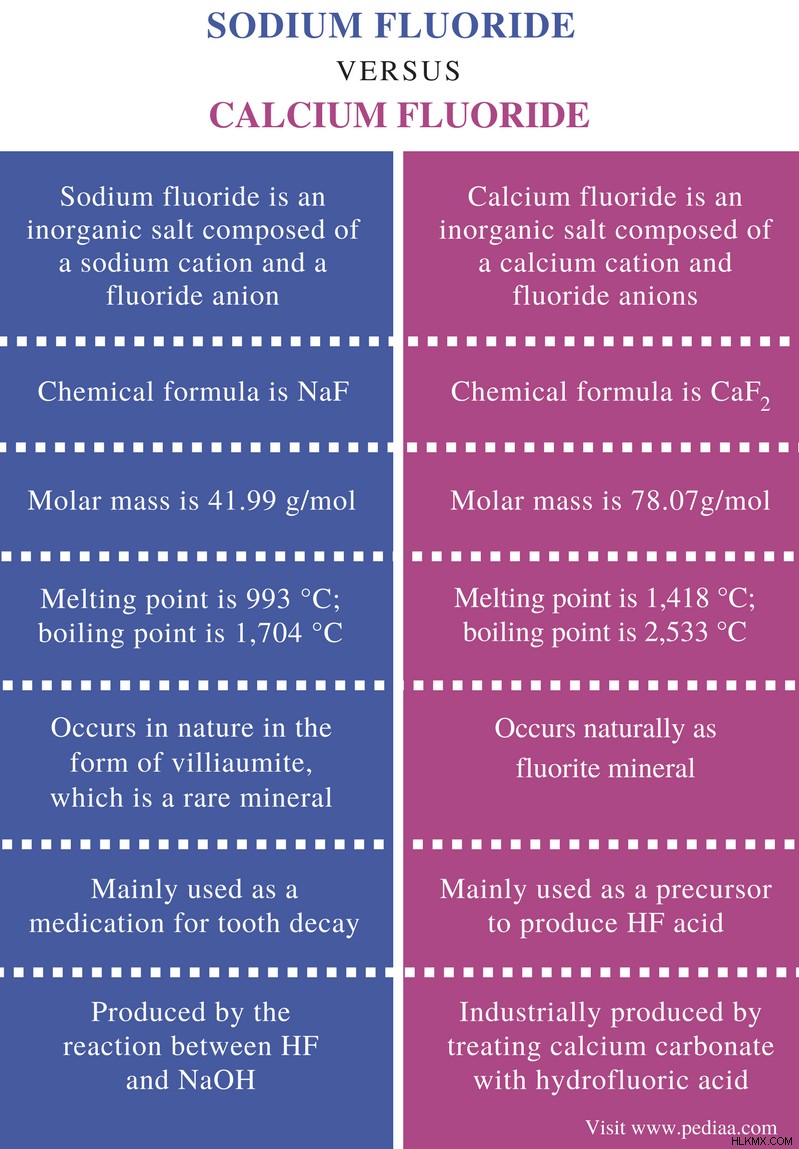
불화 나트륨은 나트륨 양이온 및 불소 음이온으로 구성된 무기 염입니다. 불소 나트륨의 화학적 공식은 naf 입니다 . 이 화합물의 몰 질량은 41.99 g/mol입니다. 무취 인 흰색에서 녹색의 고체 화합물입니다.
불소 나트륨의 융점은 993 ° C이고 끓는점은 1,704 ° C입니다. 불화 나트륨은 이온 성 화합물입니다. 이 화합물은 클로라이드 나트륨의 구조와 유사한 입방의 결정질 구조로 존재한다; naCl.
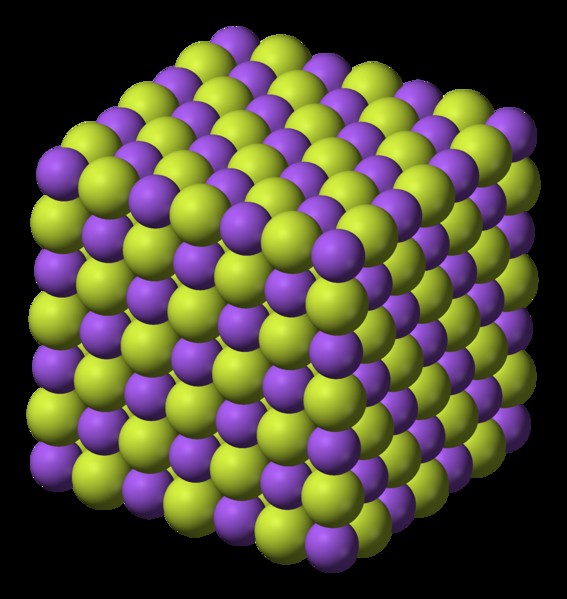
그림 1 :불소 이온 구조 나트륨
불화 나트륨은 자연에서 비네 미트의 형태로 발생합니다. 그러나 응용 프로그램을 위해 산업적으로 만들어졌습니다. 그것은 적합한 염기를 사용하여 하이드로 플루오르 산 (HF)의 중화에 의해 생성된다. 여기에는 HF와 NAOH 사이의 반응이 포함됩니다. HF는 습식 과정에 의해 플루오로 포스페이트로부터 인산의 생산의 부산물로서 얻어진다.
hf+ naoh → naf+ h 2 o
나트륨 플루오 라이드는 나트륨 양이온 및 불소 음이온으로 구성됩니다. 낮은 불소 흡수로 인한 충치를 방지하기 위해 약물로 사용됩니다. 또한 식수의 불소 함량이 낮은 지역의 어린이를 치료하는 데 사용됩니다. NF는 또한 합성 및 추출 야금을위한 화학에 많은 응용을 가지고 있습니다. 또한 유기 합성 반응, 세정제 및 식물 수유 곤충의 독으로 사용됩니다.
불소 칼슘이란 무엇입니까
칼슘 불소는 칼슘 양이온 및 불소 음이온으로 구성된 무기 염입니다. 불화 칼슘의 화학적 공식은 CAF 입니다 2 , 몰 질량은 78.07g/mol입니다. 그것은 백색 결정질 고체로 보입니다. 그러나 불소 칼슘의 단결정은 투명합니다.

그림 2 :칼슘 불소 분말
불소 칼슘의 융점은 1,418 ° C이고 끓는점은 2,533 ° C입니다. 불소 칼슘은 자연적으로 불소 미네랄로서 발생합니다. 다른 불순물의 존재로 인해 깊은 색이 있습니다. 풍부하지만 주로 HF 산의 생산에 사용됩니다. 고순도 칼슘 불소는 칼슘 탄산염을 처리하여 산업적으로 생성됩니다 (Caco 3 ) 히드로 플루오르 산 (HF).
caco 3 +2HF → CAF 2 +Co 2 +h 2 o
응용 분야로서 자연적으로 발생하는 불소는 HF 산의 생산을위한 전구체로 사용됩니다. 이 생산 공정은 황산과의 불소 반응을 포함하며, 이는 황산 칼슘을 생성합니다 (Caso 4 ) 고체 및 HF 가스. 불화 칼슘은 창, 렌즈 등과 같은 광학 성분의 생산에 사용됩니다.
불소 나트륨과 불소의 차이
정의
불소 나트륨 : 불화 나트륨은 나트륨 양이온 및 불소 음이온으로 구성된 무기 염입니다.
칼슘 불소 : 불화 칼슘은 칼슘 양이온 및 불소 음이온으로 구성된 무기 염입니다.
화학식
불소 나트륨 : 불소 나트륨의 화학적 공식은 NAF입니다.
칼슘 불소 : 불화 칼슘의 화학적 공식은 CAF 2 이다 .
몰 질량
불소 나트륨 : 불화 나트륨의 몰 질량은 41.99 g/mol.
이다칼슘 불소 : 불소 칼슘의 몰 질량은 78.07g/mol.
입니다용융점 및 끓는점
불소 나트륨 : 불화 나트륨의 융점은 993 ° C이고 끓는점은 1,704 ° C입니다.
칼슘 불소 : 불소 칼슘의 용융점은 1,418 ° C이고 끓는점은 2,533 ° C입니다.
발생
불소 나트륨 : 불화 나트륨은 자연에서 비밀 미네랄 인 Villiaumite의 형태로 발생합니다.
칼슘 불소 : 불소 칼슘은 자연적으로 불소 미네랄로 발생합니다.
사용
불소 나트륨 : 불화 나트륨은 주로 충치 약물로 주로 사용됩니다.
칼슘 불소 : 불화 칼슘은 주로 HF 산을 생산하기위한 전구체로 사용됩니다.
생산
불소 나트륨 : 불화 나트륨은 HF와 NaOH 사이의 반응에 의해 생성됩니다.
칼슘 불소 : 불화 칼슘은 탄산 칼슘을 처리하여 산업적으로 생성됩니다 (Caco 3 ) 히드로 플루오르 산 (HF).
결론
불소 나트륨 및 불소 칼슘은 불소 염입니다. 불소 나트륨과 불화 칼슘의 주요 차이점은 불소 나트륨이 하나의 불소 음이온과 관련하여 하나의 나트륨 양이온을 함유하는 반면, 불소 칼슘은 2 개의 불소 음이온과 관련하여 하나의 칼슘 양이온을 함유한다는 것입니다.
.참조 :
1.“불화 나트륨.” 국립 생명 공학 정보 센터. Pubchem Compound Database, 미국 국립 의학 도서관, 여기에서 구할 수 있습니다.
2. Wikipedia, Wikimedia Foundation, 2018 년 1 월 20 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1. Benjah-BMM27의“나트륨-플루오 라이드 -3D- 이온성”-Commons Wikimedia
2를 통한 자체 작업 (공개 도메인). Commons Wikimedia