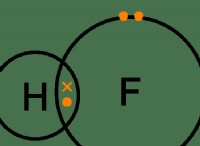
$$ 2al (s) + 3H_2SO_4 (aq) → al_2 (so_4) _3 (aq) + 3H_2 (g) $$
설명 :
알루미늄은 반응성 금속이며, 희석 황산과 반응하여 알루미늄 황산염 및 수소 가스를 생성합니다. 반응은 발열이므로 열이 방출됩니다. 반응에서 생성 된 수소 가스는 가연성이며 연료로 사용될 수 있습니다. 알루미늄 설페이트는 물에 용해되는 흰색의 결정질 고체입니다. 제지, 물 정제 및 염색의 모르 드로 다양한 응용 분야에서 사용됩니다.
알루미늄과 희석 황산 사이의 반응은 두 개의 반 반응으로 분해 될 수 있습니다.
산화 반 반응 :
$$ 2al (s) → 2al^{3 +} (aq) + 6e^-$$
감소 반 반응 :
$$ 6H^ + (aq) + 6E^- → 3H_2 (g) $$
전반적인 반응은 두 반 반응의 합입니다.
$$ 2al (s) + 6H^ + (aq) → 2al^{3 +} (aq) + 3H_2 (g) $$
이 반응은 산화 환원 반응의 예이며, 하나의 물질이 산화되고 (전자를 잃음) 다른 물질이 감소된다 (전자 이득). 이 경우 알루미늄은 산화되고 수소가 감소됩니다.