핵심 개념
이 기사에서 우리는 구조 및 산소 결합 역학을 포함하여 동물에서 가장 중요한 단백질 중 하나 인 헤모글로빈에 대해 배웁니다.
헤모글로빈 및 수송 단백질
생물학에서, 단백질은 재료가 가야 할 곳으로 가장 일반적인 방법을 제공합니다. 세포 내에서, 키네신과 같은 운동 단백질은 세포 골격 필라멘트를 따라 세포 주위의 지질 소포를 수송한다. 세포 외부에서 ABC 수송 체는 비타민 및 미네랄과 같은 중요한 영양소를 전달하는 반면, 지단백질은 콜레스테롤을 간으로, 대사 될 수 있습니다. 또한, 헤모글로빈과 미오글로빈은 신체의 모든 조직에 순환 산소에 중요한 책임이 있습니다.
헤모글로빈은 많은 생물 과학 분야의 관심을 끌었습니다. 유전 학자들은 심각한 유전 적 상태, 즉 겸상 적혈구 빈혈과의 연관성으로 인해 단백질에 관심이 있습니다. 진화 생물 학자들은 그것을 사용하는 모든 유기체에 대한 광범위한 구조적 분산으로 인해 단백질에 대한 관심을 찾습니다. 생화학 자들은 생물학적 기능에서 평형 및 호화상 개념의 중요성으로 인해 헤모글로빈에 대한 관심을 발견했다.
이 기사에서는 주로 헤모글로빈의 생화학에 중점을 둘 것입니다. 시작하려면 단백질의 구조를 탐색하기 위해 잠시 시간을 내겠습니다.
헤모글로빈 구조
앞에서 언급 한 바와 같이, 헤모글로빈은 단백질이며, 이는 주로 아미노산으로 구성되어 있음을 의미합니다. 인간 헤모글로빈의 전체 구조에는 574 개의 총 아미노산이 포함됩니다. 그러나, 이들 574는 4 개의 펩티드 서브 유닛 사이를 할당한다 :141 개의 아미노산의 2 개의 ɑ 서브 유닛 및 146 개의 아미노산의 2 개의 ß 서브 유닛. 따라서, 헤모글로빈은 4 개의 펩티드 4 차 구조로 인해 사량 체 단백질로 계산된다. 흥미롭게도 단백질은 각 서브 유닛 사이에 중심에 중요한 공동을 가지고 있습니다.
그의 펩티드 성분 외에, 각 서브 유닛은 Heme 그룹에 공유 적으로 연결된다. 이 특수 그룹에는 중심 철 (Fe) 원자가있는 유기 포르피린 고리가 포함되어 있습니다. 중요하게도,이 철은 수송을위한 규정 성 산소에 결합하는 것을 담당한다. 포르피린 고리 내의 4 개의 질소 원자는 철에 합리적으로 결합하고, 이는 또한 헤모글로빈 단백질로부터 히스티딘에 결합한다. 탈산 소화 된 형태로, 포르피린 고리는 히스티딘에서 약간의 주름 (4.0Å)을 가지고있다 (헤모글로빈 협력 결합의 이미지 참조)
.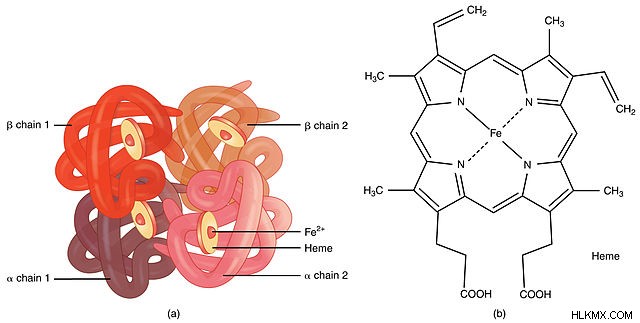
생화학 자들은 종종 효소 보조 인자 클래스와 같이 헴을“보철 그룹”이라고 부릅니다. 또한 철의 존재 및 기능으로 인해 헤모글로빈은 종종 "메탈 로프 로테인"으로 설명됩니다.
헤모글로빈 협력 산소 결합
앞에서 언급했듯이 헤모글로빈은 헴 그룹을 사용하여 산소를 운반합니다. 산소가 철에 결합 할 때, 다른 히스티딘이 상기로부터 산소를 안정화시키면서 헴 그룹의 주름이 평면으로 평평 해집니다.
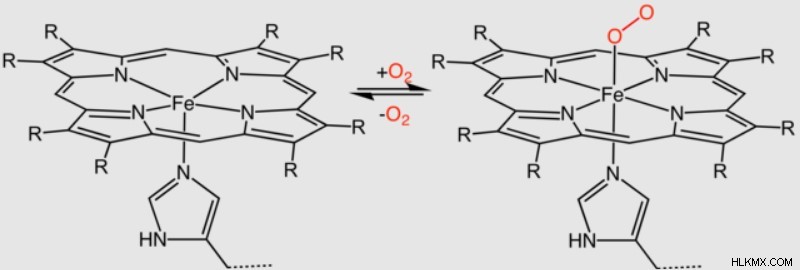
중요하게도, 산소의 결합은 또한 헤모글로빈 구조의 구조적 변화의 캐스케이드를 자극한다. 이러한 변화는 궁극적으로 하나의 ɑ-ß 쌍이 다른 하나에 대해 15 ° 회전하는 것을 초래합니다. 결과적으로 단백질의 중앙 공동이 닫힙니다.

헤모글로빈 (또는 R 상태)의 이러한 산소화 된 구조는 더 제한된 형태 (또는 t 상태)보다 헴 그룹을 더 잘 노출시킨다. 따라서, 첫 번째 산소가 헴 그룹에 결합 한 후, 다른 모든 헴 그룹은 그들 자신의 산소 분자에 결합하기 위해 훨씬 더 강한 친화력을 갖는다. 생화학 자들은“협력 적 바인딩”이라는 용어를 사용하여 한 결합의 이러한 현상을 설명하여 후속 바인딩의 가능성을 증가시킵니다.
또한, 단백질이 산소로 완전히 포화되어 완전한 R 상태에 도달하면, 첫 번째 산소가 해리 된 후 구조적 변화가 역전된다. 그런 다음 다른 모든 헴 그룹은 산소에 대한 친화력을 약간 잃어 두 번째 해리가 더 가능성이 높아지고 그 후 3 분의 1이 더 높아집니다.
.궁극적으로, 헤모글로빈의 협력 결합 능력은 산소가 풍부한 조건에서 쉽게 산소 결합을 초래하고 산소 부족 조건에서 쉬운 해리를 초래합니다. 산소가 풍부한 폐에서 헤모글로빈이 빠르게 포화되지만 산소가 부족한 조직에 도달하면 산소를 자동으로 내리는 것처럼 이것은 산소 수송에 엄청나게 유익합니다.
.헤모글로빈 돌연변이 :낫 세포 빈혈
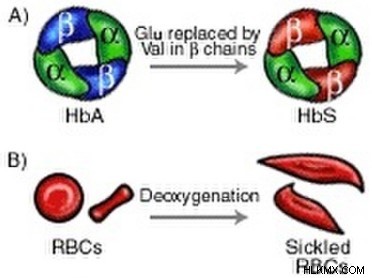
모든 단백질과 마찬가지로, DNA 서열은 궁극적으로 최종 3 차원 구조를 알려주는 헤모글로빈의 아미노산 서열을 지시한다. 그러나, DNA는 때때로 약간 다른 서열으로 돌연변이되는 경향이있다. 인간 헤모글로빈을 코딩하는 유전자의 이러한 돌연변이 중 하나는 두 ß 서브 유닛에서 발린 (VAL)에 대한 글루탐산 (GLU)을 대체한다. 특히, GLU는 극성 구조를 가지고 있으며, 단백질 외부의 용매와 상호 작용하는 데 적합한 반면, Val은 비극성입니다.
이 돌연변이는 단백질 표면에 새로운 소수성 포켓을 생성하며, 이는 다른 헤모글로빈의 소수성 그룹을 고수합니다. 궁극적으로, 돌연변이 된 헤모글로빈의 응집은 탈산 소화 될 때 겸상형 형태로 운반하는 적혈구를 변형시킨다. 이들 변형 된 세포는 야생형 혈액 세포보다 막히고 산소를 덜 운반하는 경향이있다. 결과적으로,이 유전 적 상태를 가진 환자는 통증과 혈액 관련 질병의 가능성이 높을 수 있습니다. 흥미롭게도, 겸상 적혈구 빈혈은 또한 야생형 혈액보다 말라리아에 대한 내성이 더 높은 경향이 있으며, 이는 인간 유전자 풀에서의 지속성에 대한 가능한 이유를 시사한다.
.