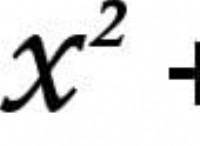속도 상수 (k)와 온도 (t) 사이의 관계는 종종 Arrhenius 방정식에 의해 설명됩니다.
k =ae^(-ea/rt)
어디:
-a는 사전 지수 계수 또는 주파수 계수이며, 이는 올바른 방향과 충분한 에너지를 갖는 반응물 분자 사이의 충돌 빈도를 나타냅니다.
-EA는 반응의 활성화 에너지이며, 이는 반응물이 전이 상태에 도달하는 데 필요한 최소 에너지입니다.
-R은 가스 상수입니다 (8.314 j/mol*k)
-T는 켈빈의 절대 온도입니다
Arrhenius 방정식에 따르면, 온도 (t)가 증가함에 따라 지수 용어 e^(-Ea/rt)가 감소하여 속도 상수의 전체 증가 (k). 따라서, 더 높은 온도는 일반적으로 성공적인 충돌이 더 자주 발생하고 필요한 활성화 에너지를 보유하는 반응물 분자의 비율이 더 빠른 반응 속도를 초래한다.