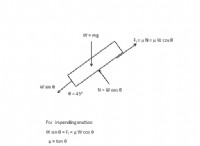
염화 비닐에서, 염소 원자 (C1)에 결합 된 탄소 원자는 이중 결합의 존재로 인해 SP2 혼성화된다. SP2 하이브리드 화는 하나의 궤도 및 2 개의 P 궤도의 혼합을 포함하여 삼각 평면 형상에 배열 된 3 개의 동등한 하이브리드 궤도를 초래한다. 이들 하이브리드 궤도는 염소 원자를 포함하여 인접한 원자와 강한 시그마 결합을 형성한다.
한편, 에틸 클로라이드에서, 염소 원자 (C1)에 결합 된 탄소 원자는 SP3 하이브리드 화된다. SP3 혼성화는 하나의 궤도 및 3 개의 p 궤도의 혼합을 포함하여, 4 개의 동등한 하이브리드 궤도가 사면체 기하학에 배열된다. 이들 하이브리드 궤도는 또한 염소 원자를 포함하여 인접한 원자와 시그마 결합을 형성한다.
탄소 원자 사이의 혼성화의 차이는 C-Cl 결합 길이에 영향을 미칩니다. 비닐 클로라이드에서, SP2 하이브리드 화 된 탄소 원자는 에틸 클로라이드에서 SP3 하이브리드 화 된 탄소 원자와 비교하여 결합이 형성되는 영역에서보다 농축 된 전자 밀도를 갖는다. 이 증가 된 전자 밀도는 탄소와 염소 원자 사이의 정전기 인력을 강화시켜 비닐 클로라이드에서 C-Cl 결합 길이가 짧다.
또한, 비닐 염화 비닐에서 이중 결합의 존재는 C-Cl 결합의 단축에 기여한다. 이중 결합은 C-Cl 결합으로부터 전자 밀도를 철회하여 염소 원자를보다 전기 음성화하고 탄소 원자에 대한 인력을 향상시킨다. 이것은 C-Cl 결합을 더욱 강화하고 길이가 짧아집니다.
요약하면, 에틸 클로라이드와 비교하여 비닐 클로라이드에서 더 짧은 C-Cl 결합 길이는 탄소 원자의 SP2 하이브리드 화, 증가 된 전자 밀도 및 이중 결합의 전자-감각 효과의 결과이다.