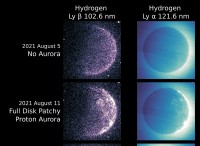
pH 5.8을 생성하는 *c "m의 *c"m 및 *d *m의 *d *m을 갖는 *V *ml를 준비하려면 다음이 필요합니다.
$$ [h^+] =10^{-5.8} =1.58 × 10^{ - 6} m $$
여기서 [H+]는 원하는 수소 이온 농도입니다.
Henderson-Hasselbalch 방정식을 사용 하여이 pH를 달성하는 데 필요한 NAH2PO4 대 NA2HPO4의 비율을 계산할 수 있습니다.
$$ ph =pka + log \ left (\ frac {[a^-]} {[ha]} \ 오른쪽) $$
어디:
* * ka *는 H2PO4-의 산 해리 상수입니다 (NAH2PO4의 컨쥬 게이트 산)
* [A-]는 Na2HPO4의 농도입니다 (NAH2PO4의 컨쥬 게이트 염기)
* [ha]는 NAH2PO4의 농도입니다 (산 형태)
25 ° C에서 H2PO4-의 *ka *는 *2.2 *10-7 *입니다. 따라서 주어진 값을 Henderson-Hasselbalch 방정식으로 대체하면 다음을 얻습니다.
$$ 5.8 =7.2 + log \ left (\ frac {[na2hpo4]} {[nah2po4]} \ 오른쪽) $$
[NA2HPO4] / [NAH2PO4]에 대한 해결, 우리는 다음과 같습니다.
$$ \ frac {[na2hpo4]} {[nah2po4]} =0.398 $$
따라서, [NAH2PO4] 대 [NA2HPO4]의 비는 5.8의 pH를 달성하기 위해서는 1 :0.398이어야한다.
2 단계 :NAH2PO4 및 NA2HPO4 용액 준비
- 분석 균형을 사용하여 필요한 양의 NAH2PO4 (0.2m) 및 NA2HPO4 (0.1m)의 무게를 측정하십시오.
- 각 화합물을 Milli-Q 물에 별도의 용기에 녹입니다.
- Milli-Q 물을 사용하여 각 용액의 부피를 500ml로 구성하십시오.
*3 단계 :NAH2PO4 및 NA2HPO4 용액을 혼합하십시오
- 두 용액을 적절한 비율로 혼합하십시오 (이 경우 0.2 M NAH2PO4 용액의 1 부피를 0.398 부피의 0.1 M NA2HPO4 용액에 혼합하십시오).
- DI 물을 추가하여 총 부피를 1 리터로 가져옵니다.
- pH 미터를 사용하여 버퍼의 pH를 확인하십시오. 필요한 경우, 0.2 M NAH2PO4 또는 0.1 M NA2HPO4 용액을 소량의 양을 추가하여 pH를 조정하십시오.