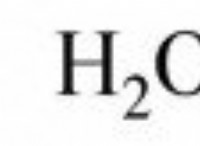1 몰의 CL2는 2 몰의 KBR과 반응하여 1 몰의 BR2를 생성한다.
Cl2의 몰 질량은 70.9 g/mol이고, Br2의 몰 질량은 159.8 g/mol이다.
따라서, 200 g의 CL2는 CL2의 200 g / 70.9 g / mol =2.82 몰이다.
화학량 론에 따르면, 2.82 몰의 CL2는 2 x 2.82 =5.64 몰의 KBR과 반응하여 2.82 몰의 BR2를 생성 할 것이다.
따라서 BR2의 이론적 수율은 2.82 몰 x 159.8 g/mol =452.3 g이다.
이제 수율 백분율을 계산할 수 있습니다.
백분율 수율 =(실제 수율 / 이론적 수율) x 100%
실제 수율은 410 g으로 제공됩니다.
백분율 수율 =(410 g / 452.3 g) x 100% =90.6%
따라서,이 반응에서 BR2의 수율은 90.6%이다.