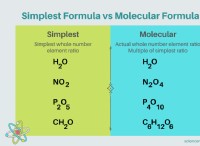
알칼리 금속이 물과 산과 빠르게 반응하는 이유는 다음과 같습니다.
1. 낮은 이온화 에너지 : 알칼리 금속은 이온화 에너지가 낮으므로 가장 바깥 전자를 잃는 것이 쉽습니다. 그들이 물이나 산과 접촉 할 때, 그들은이 전자를 쉽게 기증하여 화학 반응을 초래합니다.
2. 높은 반응성 : 알칼리 금속은 낮은 전기 음성으로 인해 반응성이 높습니다. 전기 음성은 원자가 전자를 유치하는 능력의 척도입니다. 전기 음성 요소가 적을수록 전자를 잃을 가능성이 높습니다. 알칼리 금속은 전기 음성이 낮아 전자를 잃고 화학 반응을 겪는 경향이 있습니다.
3. 수산화물 형성 : 알칼리 금속이 물과 반응하면 수산화물을 형성합니다. 수산화물은 물에 매우 용해되어 수산화물 이온 (OH-) 및 상응하는 알칼리 금속 이온 (예를 들어, Lioh, Naoh, KoH)으로 분리됩니다. 수산화물 이온은 산과 추가로 반응하여 중화 반응을 초래할 수 있습니다.
4. 산과의 빠른 반응 : 알칼리 금속은 또한 산과 격렬하게 반응합니다. 이러한 반응에서, 알칼리 금속은 산에 존재하는 수소 이온 (H+)에 전자를 기증하여 수소 가스 (H2)를 형성한다. 반응은 종종 많은 양의 열이 방출되는 것을 동반합니다.
다음은 알칼리 금속과 물 또는 산 사이의 반응의 구체적인 예입니다.
물과의 반응 :
- 리튬 (Li) + 물 (H2O) → 수산화 리튬 (LIOH) + 수소 가스 (H2)
- 나트륨 (NA) + 물 (H2O) → 수산화 나트륨 (NAOH) + 수소 가스 (H2)
- 칼륨 (K) + 물 (H2O) → 수산화 칼륨 (KOH) + 수소 가스 (H2)
산과의 반응 :
- 리튬 (LI) + 염산 (HCL) → 염화 리튬 (LICL) + 수소 가스 (H2)
- 나트륨 (NA) + 황산 (H2SO4) → 황산나트륨 (NA2SO4) + 수소 가스 (H2)
- 칼륨 (K) + 질산 (HNO3) → 질산 칼륨 (KNO3) + 수소 가스 (H2)
알칼리 금속의 물 또는 산과 반응은 매우 발열되어 상당한 양의 열을 방출합니다. 이러한 반응은 위험 할 수 있으며 통제 된 조건 하에서 수행되어야합니다.