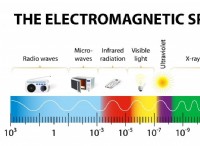
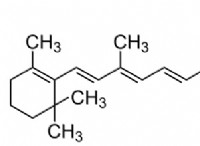
1. 가스 형성 :
반응이 가스를 생성 할 때, 분자는 더 많은 자유가 움직이고 퍼져 나갈 수있어 엔트로피가 증가합니다. 예를 들어, 고체 탄산 칼슘이 고체 산화 칼슘으로 분해되어 이산화탄소 가스를 방출 할 때, 기체 생성물로 인해 시스템의 엔트로피가 증가합니다.
2. 온도 증가 :
온도가 상승함에 따라 분자의 운동 에너지가 증가합니다. 이로 인해 더 빠른 움직임, 충돌, 무작위성이 높아져 엔트로피가 더 높아집니다. 일반적으로, 더 높은 온도에서 수행되는 반응은 더 낮은 온도에 비해 더 높은 엔트로피를 나타냅니다.
3. 고체 용해 :
고체가 액체에 용해 될 때, 용질 입자가 분산되어 용액 전체에 더 고르게 분포됩니다. 이 과정은 분자의 가능한 배열의 수를 증가시켜 엔트로피의 증가를 초래합니다.
4. 해리 반응 :
더 큰 분자를 작은 분자 또는 이온으로 분리하는 것을 포함하는 반응도 엔트로피를 증가시킨다. 예를 들어, 물에서 개별 나트륨 및 클로라이드 이온으로 염화나트륨과 같은 염의 분리는 종의 수와 가능한 배열을 증가시켜 엔트로피가 더 높아집니다.
5. 혼합 또는 희석 :
물을 알코올과 혼합하거나 농축 용액을 용매로 희석하는 것과 같은 둘 이상의 물질이 혼합 될 때, 시스템의 엔트로피가 증가한다. 다른 물질의 분자는 더 고르게 분포되어 더 많은 수의 가능한 배열을 초래합니다.
6. 위상 전이 :
용융 (고체 대 액체), 기화 (액체에서 가스에서 액체) 또는 승화 (가스에 직접 고체)와 같은 위상 전이는 분자의 배열 및 자유의 변화의 변화를 포함한다. 이러한 전이는 일반적으로 엔트로피가 증가합니다.
7. 분자의 재 배열 :
일부 화학 반응은 화학 결합의 상당한 변화없이 분자 내에서 원자의 재 배열을 포함한다. These rearrangements can increase entropy by creating more possible molecular configurations.
모든 반응이 엔트로피의 증가로 이어지는 것은 아닙니다. 일부 반응은 엔트로피가 감소하는 반면, 다른 반응은 변화가 거의 없거나 전혀 없을 수 있습니다. 엔트로피에 대한 전반적인 영향은 반응의 특정 세부 사항에 달려 있습니다.