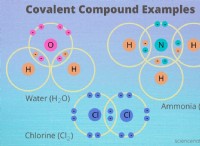
1 단계 :2.743 g 샘플에서 황산 마그네슘 몰의 수를 계산합니다.
MGSO4의 두더지 =질량 / 몰 질량
=2.743 g / 120.37 g / mol
=0.0228 mol
2 단계 :수화 된 황산 마그네슘에서 물 분자의 두더지 수를 결정하십시오.
MGSO4의 각 몰에 대해, 7 몰의 물 분자가있다.
물의 몰 =7 몰의 물 / 1 몰의 mgso4
=7 x 0.0228 mol
=0.160 mol
3 단계 :가열 중에 손실 된 물 질량을 계산하십시오.
물의 몰 질량 =18.02 g/mol
물의 질량 손실 =물의 몰 x 몰 덩어리 물의 물질
=0.160 mol x 18.02 g/mol
=2.883 g
4 단계 :냉각 된 탈수 된 소금의 질량을 계산하십시오.
냉각 된 탈수 된 소금의 질량 =원래 샘플의 질량 - 물의 질량 손실
=2.743 g -2.883 g
=-0.140 g
음의 값은 냉각 된 탈수 된 염의 질량이 가열 동안 물 분자의 손실로 인해 샘플의 원래 질량보다 작다는 것을 나타냅니다.