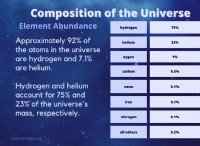
```
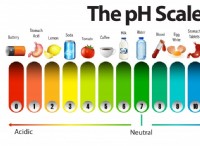
pH =-log10 [H3O+]
```
여기서 [H3O+]는 용액에서 수소 이온의 농도, 리터당 몰 (M)입니다.
두 용액 사이의 pH 차이는 첫 번째 용액의 pH로부터 두 번째 용액의 pH를 빼서 계산할 수 있습니다.
```
pH 차이 =ph1 -ph2
```
예를 들어, 용액의 pH가 4이고 다른 용액의 pH가 6 인 경우, pH 차이는 6-4 =2입니다. 이는 두 번째 솔루션이 첫 번째 용액보다 더 기본적이라는 것을 의미합니다.
pH 차이는 또한 다음 방정식을 사용하여 용액에서 수소 이온의 농도를 계산하는 데 사용될 수 있습니다.
```
[H3O+] =10^-PH
```
예를 들어, 용액의 pH가 4 인 경우, 용액에서 수소 이온의 농도는 다음과 같습니다.
```
[H3O+] =10^-4 =1 × 10^-4 M =100 μm
```