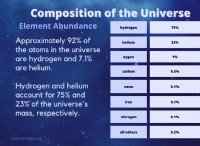
- 바륨 (BA)의 원자 질량은 137.33 g/mol입니다.
- 질소의 원자 질량 (N)은 14.01 g/mol입니다.
- 산소 (O)의 원자 질량은 16.00 g/mol입니다.
따라서 1 몰의 질산 바륨 질량은 다음과 같이 계산 될 수 있습니다.
BA의 질량 (NO3) 2 =(1 × 137.33 g/mol) + (2 × 14.01 g/mol) + (6 × 16.00 g/mol)
=137.33 g/mol + 28.02 g/mol + 96.00 g/mol
=261.35 g/mol
따라서, 질산 바륨 1 몰의 질량은 261.35 그램입니다.