황의 황소에 대해 들어 보셨습니까? 옥시 산은 산소 원자를 함유하는 산입니다. 황 옥스 산, 황산, 황산, 퍼 옥시-설 푸르 산, 티오 닉산 등과 같은 황산을 형성합니다. 황의 옥시 세이드의 가장 낮은 구성원이 어느 쪽인지 알 수 있습니까? 특성과 구조는 무엇입니까? 그 용도는 무엇입니까? 이 섹션은 황 옥소 산의 가장 낮은 멤버에 관한 것입니다.
황산이란 무엇입니까?
황은 많은 수의 옥시 산으로 유명합니다. 이 산은 자유 상태, 용액의 형태 또는 소금으로 존재합니다.
이제 그 질문에 대답하기 위해 황산은 무엇입니까? 간단히 말해서, 그것은 황의 산소 중 하나라고 할 수 있습니다. 황의 산소는 세 시리즈로 분류됩니다. 이 세 시리즈 중 하나는 황산 시리즈입니다.
가장 강력한 것은 황산입니다. 이산화황 용액은 황산의 또 다른 이름입니다. Dibasic Acid. 황산에서 S-Atom은 +4 산화 상태에 있습니다. 이 산은 불안정하기 때문에 자유 형태로 찾을 수 없습니다. 솔루션에서만 이해됩니다.
황산 구조
황산의 분자 공식은 HASSOAS입니다. OS (OH) ₂로도 쓸 수도 있습니다. 황산 구조는 다음과 같습니다.
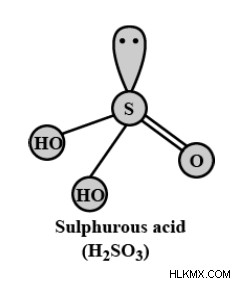
H ₂소는 황이 이산화황 용액, 디 하이드로겐 트리록소 설페이트 또는 트리 옥소 황산으로 알려져 있습니다. Lewis Dot Structure의 규칙에 따라 분자에서 전기 음성이 가장 낮은 S-Atom은 구조의 중심에 있습니다. 화학자들이 제안한 바와 같이 두 개의 황산 구조가 있습니다. 이것들은
입니다1. 대칭 구조 :
3 개의 O-Atoms는 대칭적인 황산 구조에서 S-Atom을 둘러싸고 있습니다. 2 개의 H-Atoms는 수산화물 그룹을 형성하는 2 개의 O-Atoms에 부착된다. 하나의 O- 원자는 이중 결합 또는 S-Atom과의 좌표 결합을 형성합니다.
2. 비대칭 구조 :
비대칭 황산 구조에서, S-Atom은 3 개의 O- 원자와 1 개의 H- 원자로 둘러싸여있다. 나머지 H- 원자는 수산화물 그룹을 형성하는 하나의 O- 원자에 부착된다. 그리고 다른 두 개의 o- 오 원자는 S-Atom과 함께 두 개의 이중 또는 좌표 결합을 형성합니다.
일반적으로 두 황산 구조는 서로 공명으로 존재합니다. 황산의 기하학은 삼각 피라미드입니다.
황산의 제조
황산은 물에서 SO₂의 용액으로 여겨진다. 황산을 준비하는 두 가지 방법이 있습니다. 이것들은
입니다방법 1 : 이산화황을 사용하여.
산의 용액은 물에 SO를 용해시킴으로써 얻어진다.
so₂ + h₂o → h₂so₃
방법 2 : thionyl 클로라이드를 사용하여.
hoso₂는 또한 클로라이드 티오닐에 물의 작용에 의해 제조 될 수있다.
socl₂ + 2h₂o → h₂so₃ + 2hcl
황산 특성
일부 황산 특성 목록은 다음과 같습니다.
- 황산 용액은 SO₂의 냄새를 제공하여 용액을 가열하는 데 진화했습니다. 따라서, h₂so₃는 자유 so₂ 가스로 평형에 존재합니다.
h₃so₂ ⇌ h₂o + so₂
- H₂O에서 SoS의 포화 용액이 3 ℃로 냉각 될 때, 6 각형의 결정, so₂.6h₂o, 별도.
- 산성 특성 : 그것은 dibasic 성질을 보여줍니다.
h₃so₂ ⇌ h⁺ h + hso₃⁻
hso₃⁻ h h⁺ + so₃²⁻
- 분해 : 황산 용액이 150 ℃에서 밀봉 된 튜브에서 가열되면 황이 증착됩니다.
3h ₂so 3 → 2h₂so₄ + h₂o + s
- 속성 감소 : 강력한 환원제 역할을합니다. 특정 물질을 감소시킬 때 황산은 HASSO에 산화되어 초기 수소를 제공합니다.
h₃so₂ + h₂o → h₂so₄ + 2 [h]
- 산화 특성 : 또한 산화제 역할을합니다. 특정 물질을 산화 시키면 대부분의 경우 황으로 감소됩니다.
h₃so₂ → s + h₂o + 2 [o]
- 표백 속성 : 환원제 역할을하므로 초기 수소를 쉽게 방출 할 수 있습니다. 이 초기 수소는 유색 물질을 무색 물질로 만들 수 있습니다.
h₃so₂ + h₂o → h₂so₄ + 2 [h]
- h₂oSo₂ 분자는 산소와 황 원자를 쉽게 흡수하여 h₂so₄ 및 h₂s₂o₃ (티오 설 푸르 산)를 형성 할 수 있습니다.
h₃so₂ + [o] → h₂so₄
h₃so₂ + [s] → h₂s₂o₃
- Zn-Dust의 행동 : hedso heat가 Zn-dust로 가열되면, 아연 hyposulfite (zns₂o₄)가 얻어집니다.
h₃so₂ + zn → zns₂o₄ + 2h₂o
황산의 다른 화학 반응
- hoSo₂는 할로겐 (x)을 해당 히드 래시 (HX)로 감소시킨다.
h₃so₂ + h₂o + x₂ → h₂so₄ + 2hx
- kmno₄의 산성화 된 솔루션은 mnso₄ 용액으로 감소됩니다.
2kmno₄ + 5H 샤도 → k₂so₄ + 2mnso₄ + 2h ₂so₄ + 3h
- k₂cr ofo₇의 산성화 된 용액
k₂cr₂o₇ + h₂so₄ + 3h₂so₃ → k₂so₄ + cr₂ (so₄ + 4h₂o
- 황산은 Fe₂ (so₄) ₃를 feso₄로 감소시킵니다.
h₃so₂ + h₂o + fe₂ (so₄) → 2h → so₄ + 2feso₄
- 요오드 레이트의 산성화 된 용액을 i 로 줄입니다
5H ₂ SOAT + 2KIO₃ → 4H₂SO₄ + ko + h₂o + i₂
- 황산 산화는 h₂s를 s로 산화시키고 s로 감소합니다.
h₃so₂ + 2h₂s → 3s + 3h₂o
- 1000 ℃에서, h 그것은 h₂O로 산화되고, h₂so₃는 s로 감소된다.
h₃so₂ + 2h₂ → s + 3h₂o
- hoSo₂는 Sncl₂ 및 Hg₂Cl₂ 각각을 Sncl₄ 및 HGCl에 산화하는 동안 황으로 감소합니다.
h₃so₂ + 2sncl₂ + 4hcl → s + 3h + 2sncl₄
h₃so₂ + 2hg₂cl₂ + 4hcl → s + 3h₂o + 4hgcl₂
중화 황산
설 폰산을 중화시키는 과정은 다음과 같은 방식으로 수행됩니다.
- 설 폰산을 천천히 알칼리 수산화 수성 용액에 붓습니다. 산을 첨가하면서 용액을 지속적으로 저어줍니다.
상업용 운영 에서이 프로세스는 간헐적으로 또는 지속적으로 수행 될 수 있습니다.
- 실온 또는 정상 조건에서, 황산은 알킬 탄산염과 반응한다. 그리고 황산을 중화시킵니다.
- 50% 가성 소다 용액은 또한 황산을 중화시킬 수 있습니다. 황색 페이스트는 50% 가성 소다 용액을 황산과 반응하여 얻습니다.
황산 사용
황산의 존재를 증명하는 것은 거의 없으므로 일부 황산 용도가 있습니다. 이것들은
입니다- 황산은 강한 환원제입니다. 황산이 다른 물질을 감소시킬 때 최대 +6까지 산화 될 수있는 +4 산화 상태가 있습니다.
- 염소를 염산으로 줄일 수 있습니다.
- 다른 산소 원자를 받아들이서 황산염 또는 황산으로 산화 될 수 있습니다.
- 모자와 가방과 같은 밀짚과 종이 제품을 표백하는 데 사용됩니다.
- 좋은 소독 제로 사용됩니다.
황산의 독성
황산 사용 외에도 일부 독성 문제가 있습니다. 불리한 경우,
- 그것은 피부 독소 일 수 있고 피부 화상을 초래할 수 있습니다.
- 독성 가스 및 증기 또는 금속 연기의 흡입으로 영향을받는 폐의 염증을 유발할 수 있습니다.
- 설사, 과과성 등과 같은 위장 문제를 일으킬 수도 있습니다.
- 사람들이 황산 연기를 흡입 한 후 메스꺼움이나 구토를 경험할 때 일부 사례가 기록됩니다.
황산에 대해 기억해야 할 점
- 순수한 형태를 사용할 수 없습니다.
- 치료 kituo에 의해 알려진 불량한 무인산입니다.
- 물의 이산화황 용액으로 간주됩니다.
- 삼각 피라미드 구조가 있습니다.
- 솔루션은 So₂의 냄새를 제공합니다.
- 솔루션 형식으로 존재합니다.
- 그것은 설 폰산의 팽팽한 이성질체입니다.
- 연소시, 매운 황 냄새를 제공합니다.
- Socl₂을 물과 반응하여 얻습니다.
- 150 ℃에서 가열되면 물, 황산 및 황으로 분해 될 수있다.
- 황산의 주요 성분은 산성 비입니다.
- h₂so₃의 끓는점은 -60 ℃입니다.
- 그것은 조직과 금속에 부식성입니다.
- 그것은 분사산이며 두 개의 양성자, 즉 두 개의 h⁺ 이온을 기증 할 수 있습니다.
- 수소 설파이트의 컨쥬 게이트 산입니다.
- 황산의 몰 질량은 82.07 g/mol. 입니다
결론
결론적으로, 황산은 황 옥소 산이다. 직접 문서는이 산의 솔루션에 존재한다는 것을 증명하지 않지만 분자는 기체상에서 감지되었습니다. 황산은 황의 연마성 옥소 세이드 및 황토 머 형태의 설 폰산이다. 순수하고 무수 황산 (HASSOA)을 설명 할 수 없기 때문에, 이산화물 용액은 종종 황산으로 지칭된다.
그것들은 감소 제 및 소독제로 사용됩니다. 독성이있는 황의 발암 물질 연기를 방출함에 따라 황산은 황의 발암 물산입니다. 연기를 흡입하거나 황산과 접촉하면 의학적 조언을 구해야합니다.
자주 묻는 질문
1. 황산이 강하거나 약합니까?
A. 약산은 물에 부분적으로 분리되어 약산 및 이온을 함유 한 평형 상태를 초래합니다. 수성 상태에서 H ₂소 ₂는 전적으로 H3O⁺ 또는 H⁺ 및 바이 설 파이 이온에 분리되지 않는다. 이는 바닥이 예를 들어 물이있을 때 양성자 (HAT)를 보존 할 때 바이 설 파이 이온이 상대적으로 더 강하다는 것을 의미합니다. 따라서, 황산 (H₂SOA)은 약산이다.
2. 황산은 건강 위험을 유발합니까?
A. 황산은 부식성 화학 물질입니다. 황산은 그 용도 외에도 건강 위험을 유발합니다.
- 황산과 직접 접촉하면 심한 자극을 유발하고 피부를 태울 수 있습니다.
- 눈에 손상을 줄 수도 있습니다.
- 흡입시 황산은 목과 코를 자극 할 수 있습니다.
- 호흡 황산 산, h₂so₃는 폐를 자극 할 수 있습니다.
- 기침이나 호흡 곤란을 유발할 수 있습니다.
3. 어느 것이 더 강한 산 :황산 또는 황산?
A. 황산 (H₂시) 및 황산은 분할에서 2 개의 양성자 (h⁺)를 초래하는 디 프로산으로, 분할에서 2 개의 양성자 (H⁺)를 초래한다. 그럼에도 불구하고 황산 (H₂SOA)은 강력한 산입니다. 최초의 양성자 해리가 h₂so₃에 비해 가장 선호되기 때문입니다.







