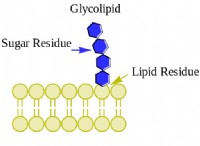
$$ N_2 + 3H_2 \ RIMERARROW 2NH_3 $$
생산할 수있는 암모니아의 양을 결정하려면 먼저 이용 가능한 수소의 두더지 수를 계산해야합니다. 수소의 몰 질량 (H2)은 2.016 g/mol이다.
수소 몰의 수 =수소 질량 / 몰 질량 수소 질량
수소 몰의 수 =3.41 g / 2.016 g / mol
수소 몰의 수 =1.69 mol
균형 잡힌 화학 방정식에 따르면, 2 몰의 암모니아를 생산하려면 3 몰의 수소가 필요합니다. 따라서, 생산할 수있는 암모니아의 두더지의 수는 다음과 같습니다.
암모니아의 두부 수 =(2/3) * 수소 몰 수
암모니아의 몰 수 =(2/3) * 1.69 mol
암모니아의 두더지 수 =1.13 mol
암모니아의 몰 질량 (NH3)은 17.04 g/mol이다. 따라서 생산할 수있는 암모니아의 질량은 다음과 같습니다.
암모니아의 질량 =암모니아의 몰수 * 암모니아 몰 질량
암모니아의 질량 =1.13 mol * 17.04 g/mol
암모니아의 질량 =19.23 g
따라서 3.41 그램의 수소는 최대 19.23 그램의 암모니아를 생산할 수 있습니다.