* 분자 운동 : 가스 분자는 지속적으로 무작위로 움직이며 서로 충돌하며 용기의 벽. 이 운동을 운동 에너지 라고합니다 .
* 온도 및 운동 에너지 : 가스의 온도가 높을수록 분자가 더 빨라지고 평균 운동 에너지가 커집니다. 반대로, 낮은 온도는 분자 운동 속도가 느리고 평균 운동 에너지가 낮다는 것을 의미합니다.
* 직접 비례 : 온도와 운동 에너지의 관계는 직접적으로 비례합니다. 이것은 가스 온도를 두 배로 늘리면 분자의 평균 운동 에너지를 두 배로 늘립니다.
여기에 비유가 있습니다 : 사람들이 춤추는 그룹을 상상해보십시오. 그들이 모두 천천히 침착하게 움직이면 댄스 플로어의 "온도"가 낮습니다. 그들이 격렬하고 에너지 적으로 춤을 추기 시작하면 댄스 플로어의 "온도"가 증가합니다.
키 포인트 :
* 평균 운동 에너지 : 온도는 분자의 * 평균 운동 에너지의 척도이며, 이는 개별 분자의 속도에 약간의 변화가있을 것입니다.
* 절대 온도 : 켈빈 (k)으로 측정 된 절대 온도 스케일은 운동 에너지와 직접 관련이 있습니다. 제로 켈빈 (0 k)은 절대 제로이며, 여기서 분자 운동은 이론적으로 멈 춥니 다.
* 내부 에너지 : 가스에있는 모든 분자의 총 운동 에너지는 내부 에너지에 기여합니다.
응용 프로그램 :
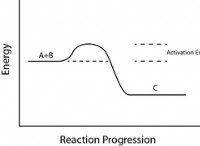
* 가스 법률 : 가스의 온도, 압력 및 부피 (이상적인 가스 법칙) 사이의 관계는 분자의 운동 에너지를 기반으로합니다.
* 열역학 : 열과 에너지 전달에 대한 연구는 온도가 분자 운동과 어떤 관련이 있는지 이해하는 데 크게 의존합니다.
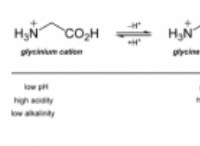
* 화학 : 화학 반응은 종종 온도에 의해 영향을 받는다. 분자가 충돌하고 반응하는 속도에 영향을 미치기 때문이다.
더 이상 질문이 있으면 알려주세요!