주요 차이 - 모나토미어 대 다 원자 이온
모나토미아 및 다 원자법이라는 용어는 분자 또는 이온의 원자력을 설명합니다. 원자력은 분자 또는 이온에 존재하는 원자의 수입니다. 이것은 모나토미아와 다 원소 이온의 주요 차이점입니다. 모나토미 이온은 단일 원자로 구성되는 반면, 다 원자 이온은 이온 당 2 개 이상의 원자로 구성됩니다 . 이들 이온은 양이온 또는 음이온 일 수있다. 모나토미틱 및 다 원소 이온은 반대 전기 전하의 이온과 정전기 인력을 가짐으로써 이온 성 화합물을 형성 할 수있다.
. 주요 영역을 다루었습니다
1. 모나토미 이온이란?
- 정의, 형성, 예
2. 다 원자 이온은 무엇입니까
- 정의, 형성, 예
3. 모나토미아와 다 원소 이온의 차이점은 무엇입니까?
- 주요 차이점 비교
주요 용어 :음이온, 원자력, 양이온, 공유 결합, 정전기 관광 명소, 원소, 이온, 모나토미 양성, 모나상 양이온, 모나상 이온, 다 원자 이온

모나상 이온은 무엇입니까
모나상 이온은 이온 당 단일 원자를 함유하는 이온입니다. 이들은 양이온이나 음이온 일 수 있습니다. 일부 원자는 가장 외부 전자 쉘에서 원자가 전자를 제거함으로써 이온을 형성합니다. 이 이온은 Monatomic 양이온입니다 . 일부 이온은 가장 바깥 쪽 전자 쉘에서 전자를 얻어 형성된다. 이들은 모나토미아 음이온으로 알려져 있습니다 . 다음 표는 그룹 1 및 그룹 17 요소에 의해 형성된 모나토미 이온을 보여줍니다.
|
모나상 양이온
|
모나상 양이온
|
|
Li
|
f
|
|
na
|
cl
|
|
k
|
br
|
|
CS
|
나는
|
일부 요소는 모나상 이온 만 형성 할 수 있습니다. 그러나 다른 요소는 다 원소 이온을 형성 할 수 있습니다. 모나상 이온은 그들이 보유한 원자가 전자의 수에 따라 다른 전하를 가질 수 있습니다. 예를 들어, 마그네슘 (MG)은 그룹 2 요소이며 2 개의 원자가 전자를 갖습니다. 이 두 전자를 제거함으로써 Mg는 Mg 양이온을 형성 할 수 있습니다. 그런 다음 모나토미 양이온입니다. 그러나 고귀한 가스는 원자가 완성 된 전자 구성으로 매우 안정적이기 때문에 모나토미 이온을 갖지 않습니다.
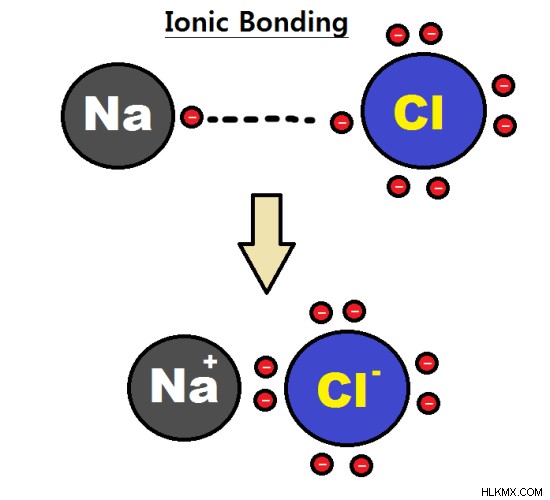
그림 1 :두 모나토미 이온 사이의 이온 결합은 규정형 분자를 형성합니다
반대 전하를 갖는 두 모나토미어 이온 사이의 결합은 규조토 분자를 형성 할 수 있습니다. 여기서, 양이온과 음이온은 정전기력을 통해 서로 끌린다. 예를 들어, 염화나트륨 (NaCl)은 나트륨 모노 토미 양이온 및 염화물 모나토미션 음이온으로 만들어집니다.
다 원자 이온은 무엇입니까
다 원자 이온은 이온 당 여러 원자로 구성된 이온입니다. 그것들은 규조토 이온, 삼중 원소 이온 일 수 있으며 그 반대도 마찬가지입니다. 알려질 수없는 수의 알려진 다 원자 이온이 있습니다. 이들 중 일부는 생물학적 시스템에 존재한다. 일부는 자연적으로 발생하는 이온 인 반면 다른 일부는 합성 이온입니다. 그것들은 매우 유용한 다 원자 이온입니다.
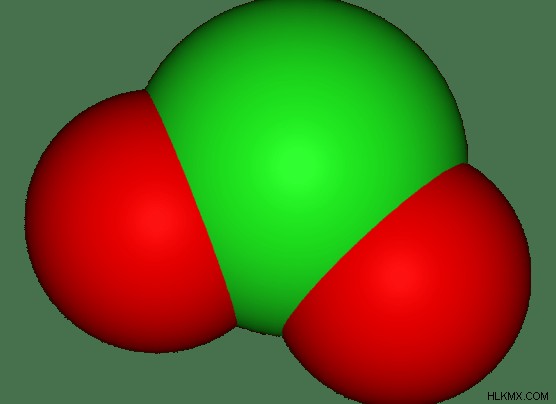
그림 2 :3 인용 이온
다 원자 이온의 원자는 서로 공유 적으로 결합됩니다. 시그마 채권뿐만 아니라 PI 결합이있을 수 있습니다. 때때로, 다 원자 이온은 배위 복합체로 형성된다. 여기서, 중앙 금속은 중립적으로 하전 된 리간드로 둘러싸여있다. 이들 리간드는 좌표 공유 결합을 통해 중앙 금속 이온에 결합된다. 그런 다음 복합체는 복잡한 이온으로 간주됩니다. 이 이온의 전하는 중앙 금속 이온의 전하입니다.
그 외에도 수백 개의 다 원자 이온이 있습니다. 그것들은 이온의 전체 전하에 따라 양이온 또는 음이온 일 수 있습니다. 다음 표는 그 중 일부를 제공합니다.
|
다 원자 양이온
|
다 원자 음이온
|
|
nh 4
|
Co 3
|
|
H 3 o
|
아니오 2
|
| [CO (h 2 o) 6 ]
|
CN
|
| [Co (nh 3 ) 6 ]
|
hso 4
|
| [ni (h 2 o) 6 ]
|
Clo 4
|
모나토미틱과 다 원소 이온의 차이
정의
모나상 이온 : 모나상 이온은 이온 당 단일 원자를 함유하는 이온이다.
다 원자 이온 : 다 원자 이온은 이온 당 여러 원자로 구성된 이온입니다.
원자 수
모나상 이온 : 모나상 이온은 이온 당 단일 원자로 구성됩니다.
다 원자 이온 : 다 원자 이온은 이온 당 여러 원자로 구성됩니다.
형성
모나상 이온 : 원자의 가장 바깥 쪽 껍질에서 전자를 잃거나 얻는 것에 의해 단호함 이온은 형성됩니다.
다 원자 이온 : 다 원자력 이온은 공유 결합을 통해 여러 원자를 함께 결합하여 형성됩니다.
화학적 결합
모나상 이온 : 모나토미 이온에는 화학적 결합이 없습니다.
다 원자 이온 : 다 원자 이온에는 공유 또는 좌표 공유 결합이 있습니다.
예제
모나상 이온 : 모나토미 이온의 예에는 Na, K, Cl 등이 포함됩니다.
다 원자 이온 : 다 원자 이온의 예는 NH <서브> 4 을 포함한다 , no 2 , no 3 등,
결론
모나상 이온과 다 원소 이온은 그 이온에 존재하는 원자의 수에 따라 명명됩니다. 모나토미아 이온과 다 원소 이온의 주요 차이점은 단일 원자로 단일 원자로 구성되는 반면, 다 원자 이온은 이온 당 2 개 이상의 원자로 구성된다는 것입니다.