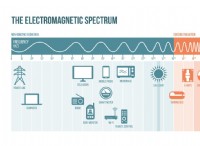
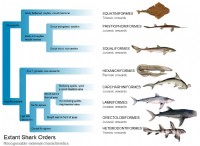
이유는 다음과 같습니다.
* 이상적인 가스 가정 : 이상적인 가스 법칙은 가스 입자가 그들이 차지하는 용기의 부피에 비해 무시할만한 부피를 가지고 있다고 가정합니다. 이것은 낮은 압력과 고온에서 잘 작동하는 단순화입니다.
* 실제 가스 거동 : 실제로 가스 분자는 유한 한 부피를 가지고 있습니다. 높은 압력에서, 분자의 부피는 용기 부피의 상당 부분이된다. 이것은 분자가 이동할 여유 공간이 적어 이상적인 가스 거동과의 편차를 초래한다는 것을 의미합니다.
* van der waals 방정식 : 반 데르 발스 방정식은 유한 한 가스 분자를 설명하는 실제 가스에 대한보다 정확한 모델입니다. 가스의 두더지 당 제외 된 부피를 나타내는 수정 항 "B"를 소개합니다.
요약 : 실제 가스에서 입자의 양을 무시하면 특히 고압 및 저온에서 상당한 오류가 발생할 수 있습니다. 실제 가스로 작업 할 때 가스 입자의 부피를 고려하고보다 정확한 예측을 위해 Van der Waals 방정식과 같은 모델을 사용하는 것이 필수적입니다.