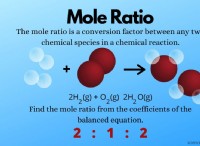
1. 평형 이해 :
* 평형 순방향 및 역 반응의 속도가 동일하고 반응물 및 생성물의 농도의 순 변화는 0 인 상태입니다.
* 평형에서 시스템은 동적 균형 상태에 있으며, 전방 및 역 반응은 계속되지만 동일한 속도입니다.
2. 평형 상수 (k) :
* 일반적인 가역적 반응 : AA + BB b CC + DD
* 평형 상수 (k)는 다음과 같이 정의됩니다
k =([c]^c * [d]^d) / ([a]^a * [b]^b)
* 어디:
* [a], [b], [c] 및 [d]는 반응물 및 생성물의 평형 농도입니다.
* A, B, C 및 D는 균형 화학 방정식의 화학량 론적 계수입니다.
3. K : 결정
* 실험적으로 :
* 모든 반응물 및 제품의 평형 농도를 측정합니다. 이것은 분광 광도법, 적정 또는 크로마토 그래피와 같은 다양한 분석 기술을 사용하여 수행 할 수 있습니다.
* 측정 된 농도를 평형 상수 발현으로 대체합니다.
* 열역학 데이터 :
* 반응의 깁스 자유 에너지 변화 (ΔG °) 사용 :
* ΔG ° =-rtlnk
* 어디:
* R은 이상적인 가스 상수입니다
* t는 켈빈의 온도입니다
* 위의 방정식을 사용하여 k를 계산합니다.
4. K :의 해석
* k> 1 : 제품은 평형에서 선호되며 반응은 크게 완료 될 것입니다.
* k <1 : 반응물은 평형에서 선호되며 반응은 많이 완료되지 않습니다.
* k =1 : 반응은 동일한 양의 반응물 및 생성물로 평형 상태에있다.
중요한 점 :
* 온도 의존성 : 평형 상수는 온도 의존적입니다. 온도의 변화는 평형 위치를 이동시키고 K의 값을 변화시킵니다.
* 단위 : 평형 상수는 차원이없는 양이므로 단위가 없음을 의미합니다.
* 이종 평형 : 고체 및/또는 액체를 포함하는 반응의 경우, 평형 상수 발현은 그들의 농도가 비교적 일정하게 유지되기 때문에 고체 또는 순수한 액체의 농도를 포함하지 않는다.
평형의 개념과 평형 상수를 이해함으로써, 우리는 화학, 생화학 및 화학 공학과 같은 다양한 분야에서 중요한 반응의 방향과 범위를 예측할 수 있습니다.