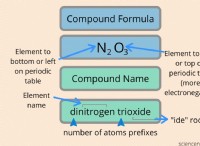
합성 반응에 대한 규칙
합성 반응은 둘 이상의 반응물이 결합되어 단일의 더 복잡한 생성물을 형성하는 화학 반응이다. 다음은 몇 가지 일반적인 규칙입니다.
1. 반응물 :
* 둘 이상의 반응물 합성 반응에 필요합니다.
* 이러한 반응물은 원소 또는 화합물 일 수 있습니다.
* 반응물은 가장 간단한 형태로되어야합니다.
2. 제품 :
* 하나의 단일 제품 합성 반응에서 형성된다.
* 제품은 반응물보다 더 복잡하므로 원자가 많거나 복잡한 구조가 더 많습니다.
3. 에너지 :
* 에너지는 종종 방출됩니다 합성 반응에서 발열을 만듭니다. 새로운 채권의 형성이 에너지를 방출하기 때문입니다.
그러나 일부 합성 반응은 흡열이므로 에너지 입력이 발생해야합니다.
4. 공식 :
* 일반 공식 : A + B → AB
합성 반응의 예 :
* 물 형성 : 2H→ + o → 2H₂O
* 염화나트륨의 형성 : 2NA + cl→ → 2NaCl
* 이산화탄소의 형성 : c + o ₂ → co₂
* 산화 마그네슘 형성 : 2mg + o₂ → 2mgo
중요한 메모 :
* 합성 반응은 조합 반응 로도 알려져 있습니다 .
* 합성 반응의 생성물은 일반적으로 더 안정적입니다 반응물보다, 더 강한 결합의 형성으로 인해.
* 균형 화학 방정식 합성 반응을 정확하게 표현하는 데 필수적입니다. 이것은 방정식의 양쪽에서 각 원소의 동일한 수의 원자를 보장합니다.
기본을 넘어서 :
* 특정 합성 반응에 필요한 특정 조건 (온도, 압력, 촉매)은 크게 다를 수 있습니다.
* 일부 합성 반응에는 여러 단계가 포함되며 상당히 복잡 할 수 있습니다.
* 합성 반응의 생성물은 다른 화학 반응에서 추가로 반응하여 더욱 복잡한 분자를 형성 할 수있다.
합성 반응의 일반적인 규칙을 이해하면 화학 반응을 이해하고 예측하기위한 토대가 제공됩니다. 이러한 규칙을 적용하면 복잡한 화학 세계를 해독하기 시작할 수 있습니다.