주요 차이 - 원자가 결합 이론 대 분자 궤도 이론
원자는 전자가 상주하는 궤도로 구성됩니다. 이러한 원자 궤도는 다른 모양과 다른 에너지 수준에서 찾을 수 있습니다. 원자가 다른 원자와 조합 된 분자에있을 때,이 궤도는 다른 방식으로 배열된다. 이들 궤도의 배열은 화학적 결합 및 분자의 형상 또는 형상을 결정할 것이다. 이들 궤도의 배열을 설명하기 위해, 우리는 원자가 결합 이론 또는 분자 궤도 이론을 사용할 수있다. 원자가 결합 이론과 분자 궤도 이론의 주요 차이점은 원자가 결합 이론은 궤도의 혼성화를 설명하는 반면 분자 궤도 이론은 궤도의 혼성화에 대한 세부 사항을 제공하지 않는다는 것입니다.
주요 영역을 다루었습니다
1. 원자가 본드 이론이란?
- 정의, 이론, 예
2. 분자 궤도 이론이란 무엇입니까
- 정의, 이론, 예
3. 원자가 결합 이론과 분자 궤도 이론의 차이점
- 주요 차이점 비교
주요 용어 :안티 본딩 분자 궤도, 결합 분자 궤도, 하이브리드 화, 하이브리드 궤도, 분자 궤도 이론, PI 결합, 시그마 본드, SP orbital, sporbital, sporbital, spdorbital, 원자가 결합 이론 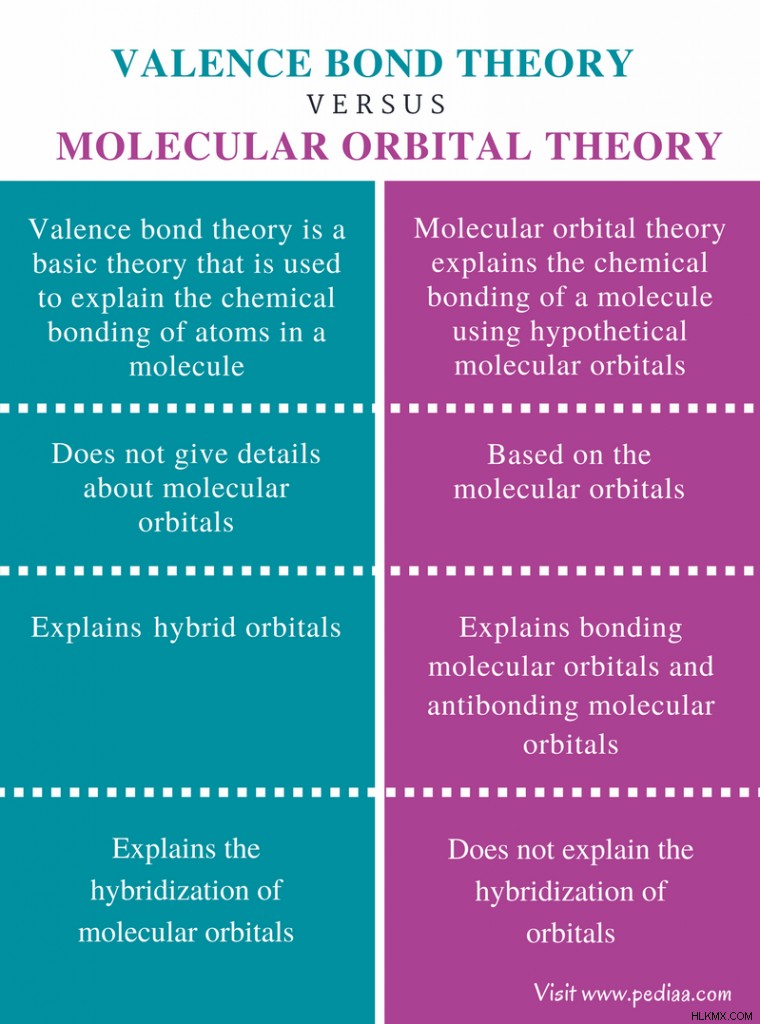
원자가 본드 이론이란 무엇입니까
밸런스 본드 이론은 분자에서 원자의 화학적 결합을 설명하는 데 사용되는 기본 이론입니다. 원자가 결합 이론은 궤도의 겹치는 것을 통한 전자의 쌍을 설명합니다. 원자 궤도는 주로 궤도, p 궤도 및 d 궤도로 발견됩니다. 원자가 결합 이론에 따르면, 2 개의 s 궤도 또는 p 궤도의 겹치는 두 궤도의 겹치는 것은 시그마 결합을 형성 할 것이다. 2 개의 평행 한 p 궤도의 겹치면 PI 결합이 형성됩니다. 따라서, 단일 채권은 시그마 채권 만 포함하는 반면, 이중 채권은 시그마 채권과 PI 결합을 포함합니다. 트리플 본드에는 2 개의 PI 결합과 함께 시그마 본드가 포함될 수 있습니다.
h 2 와 같은 단순 분자 수소 (H) 원자가 S 궤도로만 구성되기 때문에 궤도의 겹치는 것만으로는 시그마 결합을 형성합니다. 그러나 짝을 이루지 않은 전자를 가진 S 및 P 궤도로 구성된 원자의 경우, 원자가 결합 이론은 "하이브리드 화"라는 개념을 가지고 있습니다.
궤도의 혼성화는 하이브리드 궤도를 초래합니다. 이들 하이브리드 궤도는 이들 궤도 사이의 반발이 최소화되는 방식으로 배열된다. 후속 조치는 일부 하이브리드 궤도입니다.
SP Orbital
이 하이브리드 궤도는 s 궤도가 p 궤도와 혼성화 될 때 형성됩니다. 따라서, SP 궤도는 S 궤도 특성의 50%와 P 궤도 특성의 50%를 갖는다. SP 하이브리드 궤도로 구성된 원자에는 2 개의 비 하이브리드 P 궤도가 있습니다. 따라서, 이들 2 개의 P 궤도는 2 개의 PI 결합을 형성하는 평행 방식으로 겹칠 수있다. 하이브리드 화 된 궤도의 최종 배열은 선형입니다.
포자
이 하이브리드 궤도는 2 개의 p 궤도와의 s 궤도의 하이브리드 화에서 형성됩니다. 따라서,이 SP 하이브리드 궤도는 S 궤도 특성의 약 33%와 P 궤도 특성의 약 67%를 포함한다. 이러한 유형의 하이브리드 화를 겪는 원자는 하나의 UN- 하이브리드화 된 p 궤도로 구성됩니다. 하이브리드 궤도의 최종 배열은 삼각 평면입니다.
포자
이 하이브리드 궤도는 3 개의 p 궤도와의 s 궤도의 하이브리드 화에서 형성됩니다. 따라서,이 SP 하이브리드 궤도는 S 궤도 특성의 약 25%와 p 궤도 특성의 약 75%를 포함한다. 이러한 유형의 하이브리드 화를 겪는 원자는 hybridized의 궤도가 없다. 하이브리드 궤도의 최종 배열은 사면체입니다.
spdorbital
이 혼성화는 궤도, 3 개의 p 궤도 및 d 궤도를 포함합니다.
이 하이브리드 궤도는 최종 형상 또는 분자의 모양을 결정합니다.
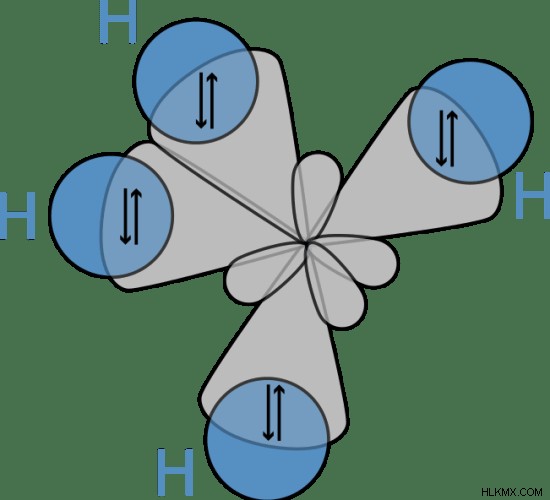
그림 1 :CH4의 기하학은 사면체입니다
위의 이미지는 ch 4 의 형상을 보여줍니다. 분자. 사면체입니다. 애쉬 색상의 궤도는 탄소 원자의 SP 하이브리드 화 궤도 인 반면, 청색 궤도는 공유 결합을 형성하는 탄소 원자의 하이브리드 궤도와 겹쳐진 수소 원자의 궤도이다.
.분자 궤도 이론이란 무엇입니까
분자 궤도 이론은 가상의 분자 궤도를 사용하여 분자의 화학적 결합을 설명합니다. 또한 원자 궤도가 겹칠 때 분자 궤도가 어떻게 형성되는지 설명합니다 (혼합). 이 이론에 따르면, 분자 궤도는 최대 2 개의 전자를 보유 할 수 있습니다. 이들 전자는 이들 사이의 반발을 최소화하기 위해 반대 스핀을 갖는다. 이들 전자는 본드 전자 쌍이라고한다. 이 이론에서 설명한 바와 같이, 분자 궤도는 두 가지 유형 일 수있다 :결합 분자 궤도 및 항 바이본 딩 분자 궤도.
결합 분자 궤도
결합 분자 궤도는 원자 궤도 (이 분자 궤도의 형성에 참여한 원자 궤도)보다 낮은 에너지를 갖는다. 따라서 결합 궤도는 안정적입니다. 결합 분자 궤도에 상징 σ.
가 주어집니다항체 분자 궤도
안티 본딩 분자 궤도는 원자 궤도보다 에너지가 더 높다. 따라서, 이들 안테이블 링 궤도는 결합 및 원자 궤도에 비해 불안정하다. 안티 본딩 분자 궤도에는 상징 σ*.
가 제공됩니다결합 분자 궤도는 화학 결합의 형성을 유발합니다. 이 화학적 결합은 시그마 결합 또는 PI 결합 일 수 있습니다. 안티 본딩 궤도는 화학 결합의 형성에 관여하지 않습니다. 그들은 채권 밖에 거주합니다. 시그마 본드는 머리부터 머리까지의 겹치는 것이 발생할 때 형성됩니다. PI 결합은 궤도의 내부에서 사이드 겹치는 형성됩니다.
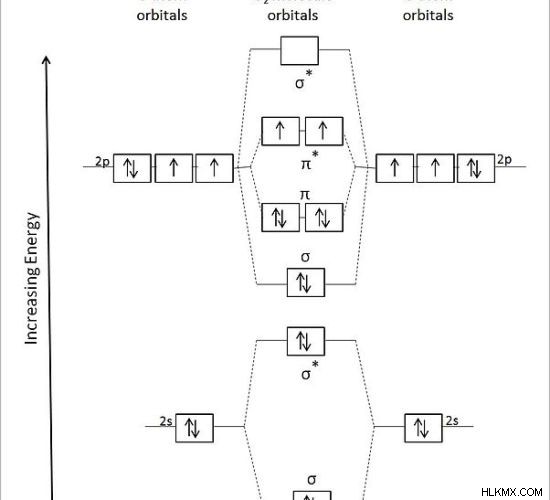
그림 2 :산소 분자의 결합을위한 분자 궤도 다이어그램
위의 다이어그램에서 두 산소 원자의 원자 궤도는 왼쪽과 오른쪽에 표시됩니다. 중간에서, o 2 의 분자 궤도 분자는 결합 및 안티 본딩 궤도로 나타납니다.
원자가 결합 이론과 분자 궤도 이론의 차이
정의
원자가 본드 이론 :원자가 결합 이론은 분자에서 원자의 화학적 결합을 설명하는 데 사용되는 기본 이론입니다.
분자 궤도 이론 : 분자 궤도 이론은 가상의 분자 궤도를 사용하여 분자의 화학적 결합을 설명합니다.
분자 궤도
원자가 본드 이론 :원자가 결합 이론은 분자 궤도에 대한 세부 사항을 제공하지 않습니다. 원자 궤도의 결합을 설명합니다.
분자 궤도 이론 : 분자 궤도 이론은 분자 궤도를 기반으로 개발됩니다.
궤도 유형
원자가 본드 이론 :원자가 결합 이론은 하이브리드 궤도를 설명합니다.
분자 궤도 이론 : 분자 궤도 이론은 결합 분자 궤도 및 안티본 딩 분자 궤도를 설명합니다.
혼성화
원자가 본드 이론 :원자가 결합 이론은 분자 궤도의 혼성화를 설명합니다.
분자 궤도 이론 : 분자 궤도 이론은 궤도의 혼성화에 대해 설명하지 않습니다.
결론
둘째 원자가 결합 이론과 분자 궤도 이론은 분자의 원자들 사이의 화학적 결합을 설명하는 데 사용됩니다. 그러나, Valance 결합 이론은 복잡한 분자의 결합을 설명하는데 사용될 수 없다. 규조토 분자에 훨씬 적합합니다. 그러나 분자 궤도 이론은 모든 분자의 결합을 설명하는 데 사용될 수 있습니다. 따라서 원자가 결합 이론보다 많은 고급 응용 프로그램이 있습니다. 이것이 원자가 결합 이론과 분자 궤도 이론의 차이입니다.
참조 :
1. "그림 분자 궤도 이론." 화학 libretexts. LibreTexts, 2016 년 7 월 21 일. 웹. 여기에서 사용할 수 있습니다. 2017 년 8 월 9 일.
2. "원자가 결합 이론 및 하이브리드 원자 궤도." 원자가 결합 이론 및 하이브리드 원자 궤도. N.P., N.D. 편물. 여기에서 사용할 수 있습니다. 2017 년 8 월 9 일.
이미지 제공 :
1. 영어 Wikipedia (원본 텍스트 :K. Aainsqatsi)의 K. Aainsqatsi의“CH4 Hybridization”-Commons Wikimedia
2를 통한 자신의 작품 (원본 텍스트 :자체 제작) (공개 도메인). Anthony.sebastian의“산소 분자 궤도 다이어그램”-Commons Wikimedia