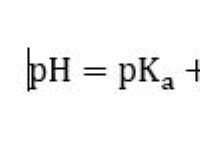1. 균형 화학 방정식
반응의 균형 화학 방정식은 다음과 같습니다.
3H w (g) + WO₃ (S) → W (S) + 3H₂O (g)
2. 두더지 비율
균형 방정식은 3 몰의 수소 (H₂)가 1 몰의 텅스텐 (W)을 생산하기 위해 반응 함을 보여준다.
3. 계산
* 수소 몰로 시작하십시오 : 2405 몰 hes
* 균형 방정식에서 두더지 비율을 사용하십시오. (1 몰 w / 3 몰 h₂)
* 텅스텐의 두부를 찾으려면 곱하십시오. 2405 몰 hes * (1 몰 w / 3 몰 h₂) = 801.67 몰 w
답 : 2405 몰의 수소와 과도한 wo₃에서 약 801.67 몰의 텅스텐을 생산할 수 있습니다.