반 데르 발스 방정식 이해
반 데르 발스 방정식은 다음과 같습니다.
[(p + a (n/v)^2)] * (v -nb) =nrt
어디:
* p : 압력
* V : 용량
* n : 몰의 수
* r : 이상적인 가스 상수
* t : 온도
"A"및 "B"값
* "A"(어트랙션) : 이 용어는 가스 분자 사이의 매력을 설명합니다. 더 큰 "A"값은 더 강한 분자간 힘을 나타냅니다.
* "b"(볼륨) : 이 용어는 가스 분자 자체가 차지하는 부피를 나타냅니다. 더 큰 "B"값은 더 큰 분자를 나타냅니다.
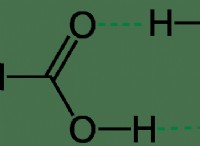
N2와 NH3 비교
1. "a"값 (attraction) : NH3은 N2보다 "A"값이 더 커집니다. 이는 NH3이 극성 N-H 결합의 존재로 인해 매우 강한 분자간 힘 인 수소 결합에 참여할 수 있기 때문입니다. N2는 런던 분산 세력이 약한 것입니다.
2. "B"값 (볼륨) : NH3은 N2보다 "B"값이 더 큽니다. NH3 분자가 N2 분자보다 크기 때문입니다.
결론 :
* NH3은 더 강한 분자간 힘으로 인해 더 큰 "A"값을 가질 것입니다.
* NH3은 분자가 더 크기 때문에 더 큰 "B"값을 가질 것입니다.