주요 차이 - S vs P 블록 요소
주기적인 요소 테이블에는 지금까지 발견 된 모든 요소가 포함되어 있습니다. 이 요소는 4 개의 주요 그룹으로 S 블록, P 블록, D 블록 및 F 블록으로 분류됩니다. 그것들은 원자가 전자가 존재하는 궤도에 따라 분류됩니다. 또한, 이들 요소는 물리적 특성에 따라 금속, 비금속 및 금속성으로 분류 될 수있다. 수소를 제외한 모든 S 블록 요소는 금속입니다. 대부분의 P 블록 요소는 비금속입니다. P 블록의 나머지 요소는 메탈 로이드입니다. S와 P 블록 요소의 주요 차이점은 S 블록 요소의 원자가 전자가 S 궤도에 있고 P 블록 요소의 원자가는 P 궤도에 있다는 것입니다.
주요 영역을 다루었습니다
1. S 블록 요소는 무엇입니까
- 정의, 특성 속성, 멤버
2. P 블록 요소는 무엇입니까
- 정의, 특성 속성, 멤버
3. S와 P 블록 요소의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :금속, 금속성, 비금속, P 블록 요소, S 블록 요소, 원자가 전자 
S 블록 요소는 무엇입니까
s 블록 요소는 원자가 전자가 가장 바깥 쪽 궤도에있는 요소입니다. S 궤도는 최대 2 개의 전자를 유지할 수 있으므로 모든 S 블록 요소는 가장 바깥 쪽 궤도에 1 또는 2 개의 전자로 구성됩니다. 전자 구성은 항상 s 궤도 (ns)로 끝납니다.
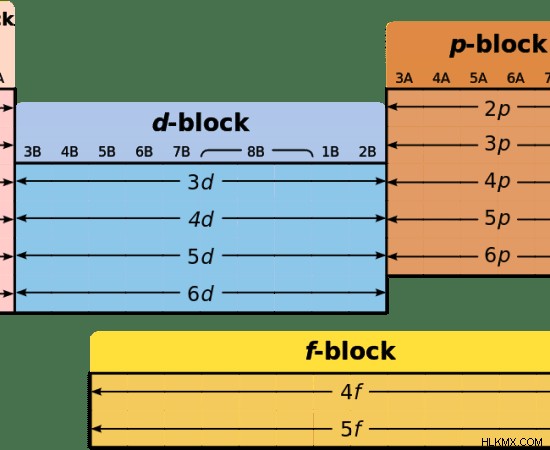
그림 1 :주기적인 요소 테이블의 블록 (S 블록은 분홍색으로)
수소를 제외하고 S 블록의 다른 모든 구성원은 금속입니다. 수소는 비금속입니다. 그러나 S 궤도 만 가지고 있으므로 S 블록 요소로 분류됩니다. 그룹 1 및 2에는 S 블록 요소가 포함됩니다. Group1a의 요소는 가장 바깥 쪽 궤도에서 하나의 원자가 전자로 구성되는 반면, 그룹 2 요소는 2 개의 원자가 전자로 구성됩니다. 그룹 1 요소는 알칼리 금속으로 선정되었으며 그룹 2 요소는 알칼리 지구 금속입니다.
헬륨은 또한 2 개의 전자로 구성된 s 궤도 만 있기 때문에 S 블록 요소입니다. 따라서, 헬륨은 또한 S 궤도에 원자가 전자를 가지며 S 블록 요소로 분류된다. 헬륨은 또한 비금속입니다.
s 블록 요소의 산화 상태는 +1 또는 +2 일 수 있습니다 (수소는 때때로 -1 산화 상태를 가짐). 이는 이들 요소가 하나의 전자 (그룹 1 요소) 또는 2 개의 전자 (그룹 2 요소)를 제거함으로써 안정적이 될 수 있기 때문입니다.
.각 기간 후 새로운 전자 쉘이 추가되어 S 블록 요소의 원자 반경이 그룹을 증가시킵니다. 이온화 에너지는 원자 반경이 증가함에 따라 그룹을 감소시킨다. 가장 바깥 쪽 궤도의 전자가 핵에 의해 약하게 끌리기 때문입니다
멜팅 포인트와 끓는점 모두 그룹이 줄어 듭니다. 금속 결합의 강도는 원자 반경의 증가에 따라 감소하기 때문입니다. 따라서 금속 원자는 쉽게 분리 될 수 있습니다.
P 블록 요소
p 블록 요소는 원자가 전자가 가장 바깥 쪽 P 궤도에있는 요소입니다. P 서브 쉘은 최대 6 개의 전자를 유지할 수 있습니다. 따라서, P 블록 요소의 가장 바깥 쪽 P 궤도에있는 전자의 수는 1, 2, 3, 4, 5 또는 6 일 수 있습니다. 전자 구성은 항상 p 궤도 (np)로 끝납니다.
대부분의 p 블록 요소는 비금속이고 다른 사람은 금속성이 거의 없습니다. 그룹 3에서 그룹 8까지는 헬륨을 제외한 P 블록 요소를 포함합니다 (헬륨은 위에서 설명한대로 S 블록에 속합니다). P 블록 요소의 원자 반경은 그룹을 증가시키고 기간에 따라 감소합니다. 이온화 에너지는 그룹을 감소시키고 그 기간에 따라 증가합니다. 전기 음성도 기간에 따라 증가합니다. 가장 전기 음성 요소는 P 블록에 속하는 불소입니다.
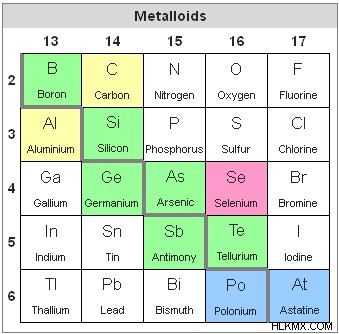
그림 2 :P 블록의 메탈 로이드
대부분의 p 블록 요소는 할당수를 보여줍니다. 할당량은 동일한 요소의 다른 형태의 분자 구조를 나타냅니다. P 블록 원소의 산화 상태는 원자에 존재하는 원자가 전자의 수에 따라 달라질 수있다. 일부 요소는 하나의 산화 상태를 가질 수 있지만 다른 원소에는 여러 산화 상태가 있습니다.
그룹 8은 고귀한 가스로 구성됩니다. 이러한 요소는 불활성 가스이며 극한 조건에서는 화학 반응을 겪을 수 없습니다. 고귀한 가스는 가장 안정적인 전자 구성을 가지며 P 궤도는 전자로 완전히 채워져 있습니다. 그룹 7 요소를 할로겐이라고합니다. p 블록의 거의 모든 원소는 공유 화합물을 형성하며 이온 결합에도 참여할 수 있습니다.
S와 P 블록 요소 간의 차이
정의
S 블록 요소 : S 블록 요소는 원자가 전자가 가장 바깥 쪽 궤도에있는 요소입니다.
p 블록 요소 : P 블록 요소는 원자가 전자가 가장 바깥 쪽 P 궤도에있는 요소입니다.
산화 상태
S 블록 요소 : S 블록 요소는 0, +1 또는 +2 산화 상태를 가질 수 있습니다.
p 블록 요소 : P 블록 요소는 -3, 0 내지 +5 (안정적인 산화 상태)로 다양한 산화 상태를 보여줍니다.
화학적 결합
S 블록 요소 : S 블록 요소는 금속 결합 및 이온 결합을 형성합니다.
p 블록 요소 : p 블록 요소는 공유 결합 또는 이온 결합 (금속 포함)을 형성합니다.
금속 특성
S 블록 요소 : 모든 S 블록 요소는 금속입니다.
p 블록 요소 : 대부분의 p 블록 요소는 비금속이고 다른 요소는 메탈 로이드입니다.
전기 음성
S 블록 요소 : S 블록 요소의 전기 음성은 비교적 적습니다.
p 블록 요소 : P 블록 요소의 전기 음성은 비교적 높다.
결론
s 및 p 블록 요소는주기적인 요소 테이블에서 발견되는 화학 요소입니다. 이들은 궤도에서 원자가 전자의 위치에 따라 S 블록 또는 P 블록으로 그룹화된다. S와 P 블록 요소의 주요 차이점은 S 블록 요소의 원자가 전자가 S 궤도에 있고 P 블록 요소의 원자가는 P 궤도에 있다는 것입니다.