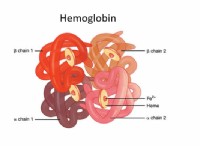
이유는 다음과 같습니다.
* 중앙 원자 : 염소 (CL)는 중앙 원자입니다.
* 원자가 전자 : 염소는 7 개의 원자가 전자를 가지며, 각 불소 (F)는 7 을가집니다. 분자는 +1 전하를 가지므로 1 개의 전자를 빼냅니다. 이것은 우리에게 총 20 개의 원자가 전자를 제공합니다.
* 본딩 : 4 개의 전자를 사용하여 염소와 각 불소 원자 사이에 2 개의 단일 결합이 형성된다.
* 고독한 쌍 : 나머지 16 개의 전자는 염소 및 불소 원자의 고독한 쌍으로 분포된다. 염소는 3 개의 고독한 쌍을 가지고 있으며, 각 불소 원자는 3 개의 고독한 쌍을 가지고 있습니다.
* 분자 형상 : VSEPR 이론에 따르면, 중앙 원자 주위에 2 개의 결합 쌍과 3 개의 고독 쌍이 선형 모양을 초래합니다.
따라서 CLF₂⁺ 분자는 결합 각인이 180 도의 선형 모양을 갖습니다.