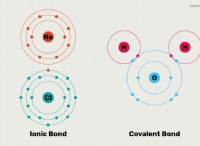
1. H2SO4의 0.50 그램이있는 경우
* H2SO4의 몰 질량을 찾으십시오.
* H :1.01 g/mol * 2 =2.02 g/mol
* S :32.07 g/mol
* O :16.00 g/mol * 4 =64.00 g/mol
* 총 몰 질량 :2.02 + 32.07 + 64.00 =98.09 g/mol
* 주어진 질량을 어금니 질량으로 나눕니다.
* 몰스 =0.50 g / 98.09 g / mol =0.0051 몰스
2. 특정 어금니가있는 0.50 리터의 솔루션이있는 경우
* H2SO4 솔루션의 몰라리 (농도)를 알아야합니다. 어금니는 리터당 두더지 (mol/L)로 정의됩니다.
* 부피에 (리터)를 곱하기 위해 두더지의 수를 얻습니다.
* Moles =0.50 l * Molarity (mol/l)
0.50에 측정 단위 (그램, 리터 등)를 제공하여 정답을 줄 수 있습니다!