sp²는 bcl₃에 나타나는 일종의 혼성화입니다. Bcl in의 붕소는 결합이있는 3 개의 전자가있는 중앙 원자로 결정되지만 한 쌍의 전자는 포함하지 않습니다. BCL₃, BCL₃ LEWIS 구조, BCL₃ 결합 각도, BCL ₃ 분자 그림 및 결합 각도 등의 혼성화를 더 이해하려면 계속 읽으십시오.
간단히 혼성화를 정의하는 방법?
1931 년 미국 화학자 인 Linus Carl Pauling은 혁신적인 혼성화 이론을 제시했습니다. 그는 혼성화를 특정 원자 궤도의 에너지의 재분배로 정의하여 동일한 에너지의 새로운 궤도를 생성했습니다.
그들은 두 개의 원자 궤도를 결합하여 혼성화라고 불리는 새로운 유형의 하이브리드 화 된 궤도를 형성했습니다. 전형적으로,이 혼합은 근본적으로 다른 에너지, 모양 등을 갖는 하이브리드 궤도의 발달을 초래한다. 동일한 에너지 수준의 원자 궤도는 주로 하이브리드 화에 책임이있다. 그러나, 그들의 에너지가 동등한 경우, 채워진 반으로 가득 찬 궤도가 참여할 수 있습니다. 혼성화 원리는 결합 형성, 본드 에너지 및 결합 길이를 이해하는 데 도움이되는 원자가 결합 이론 확장입니다.
유사성 에너지의 무한 궤도는 2p 궤도의 2s 궤도의 intermixing 또는 p-orbital과 p-orbital과의 궤도의 혼합으로 인해 유사한 하이브리드 화 방법 동안 혼합됩니다.
.bcl3의 극성
bcl3은 비극성 분자입니다. 극성 결합은 전자 밀도의 비대칭 셰이프 쉬프트를 필요로하며, BCL3에는 전기 쌍극자를 생성합니다. 화학 분자 BCL3에는 SP² 하이브리드 화 유형이 있습니다.
따라서 BCL3 패치에 걸쳐 전하의 분극이 존재하지 않습니다. 자세한 내용은 BCL3의 반대에 대한 구성을 살펴 봐야합니다.
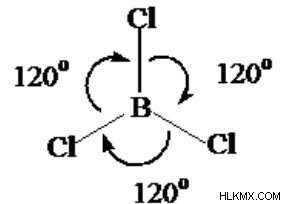
붕소 트리클로 라이드의 분자 기하학 및 결합 각도
붕소에서의 혼성화는 SP2 혼성화입니다. 이것은 Boron의 다른 원자와 결합하는 능력을 설명하고, 하나의 궤도가 채워지지 않을 때, 그것은 결합을 형성 할 준비가된다.
.sp2 혼성화 단편의 하나와 2 개의 p 궤도가 혼합되어 3 개의 원래 궤도를 형성 할 때,이 방법을 SP2 하이브리드 화라고합니다. 한 평면에서 SP2 하이브리드 화에서 생성 된 세 가지 궤도는 서로 1200을 만듭니다.
접지 상태 패턴은 1S2 2S2 2P1입니다. 그것은 단 하나의 짝을 이루지 않은 전자를 가지고 있습니다. 3 개의 연결되지 않은 전자가 필요하기 때문에 2p sublevel에서 전자의 1 2s지지가 있습니다.
따라서 패턴은 1S2 2S2 2PX1 2PY1이됩니다.
그러나 BCL3 패치의 평면 삼각형 모양을 취하려면 결합 구조를지지하기 전에 SP2 하이브리드 화가 지원됩니다.
boro gesta sp2 하이브리드 화는 1 개의 2 및 2 개의 2p 궤도를 사용하여 삼각형 평면 평형으로 알려진 3 개의 반으로 채워진 교차 SP2 궤도를 제공합니다. 또한 반으로 채워진 SP2 하이브리드 양이온을 사용하여 3 개의 염소 역가와 3 개의 SP-P 결합을 형성합니다. σ- 결합 형태의 경우, 반으로 채워진 β- 궤도가 사용된다.
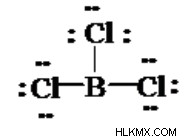
BCl> Lewis 구조
Bcl₃ Lewis 구조는 Bf ₃ (붕소 트리 플루오 라이드) 및 BBr ₃ (붕소 트리 브로마이드)와 유사합니다.
붕소는 actron을 만드는 데 8이 아닌 6 개의 전자 만 필요합니다.
단순히 최적의 BCl ₃ Lewis 구조가 있는지 확실하지 않은 경우 공식 요금을 계산할 수 있습니다. BCL의 B에 B는 6 개의 원자가 전자 만 포함되어 있는지 검사합니다.
24 개의 원자가 전자의 집계는 BCl ₃ Lewis 구조 내에 포함됩니다.
Bcl b 본드 각도
bcl₃의 결합 각도를 해결하기위한 첫 번째 단계는 루이스 구조를 만드는 것입니다.
사례의 경우 Bcl₃은 삼각 평면 일 수 있으므로 120F의 결합 각입니다. 그럼에도 불구하고 극성 일 때는 Trigonal Planar가 형태 인 경우에도 정확히 120 °의 결합 각도를 가질 수 없습니다.
패치가 두 개의 관련 그룹과 하나의 전자 버팀대를 유지하고 사기성 분자 모양을 유발하는 경우 BCl ₃ 결합 각도는 120 °보다 작습니다. 고독한 브레이스 전자 덕분에 유사한 구체의 모터는 별개의 분자 모양을 가질 수 있습니다.
결론
역사 과학자들은 바닥 상태 전자 구성이 공유 결합의 양과 일치하지 않았다는 것을 알았으며, 이들 요소는 여러 복합재에서 형성되거나 실험적으로 결정된 분자 수/ 결합 각도를 설명하지 않았다. 이에 따라, 궤도 혼성화의 원리는 실제 세계에서 실제로 관찰되는 것을 설명하기 위해 개발되었습니다. 그러나 BCL3 패치의 평면 삼각형 모양을 취하기 위해, 결합 구조를지지하기 전에 SP2 하이브리드 화가 지원된다.
.