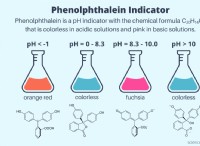
이유와 방법은 다음과 같습니다.
* 반응성 : 알루미늄은 매우 반응성이 높은 금속으로 화합물을 쉽게 형성하고 본질적으로 자유롭게 존재하지 않습니다. 전통적인 화학 환원 방법 (탄소 사용)은 공통 광석 인 산화 알루미늄 (Allool)의 강한 결합을 극복하기에 충분한 전력이 없습니다.
* 전기 분해 : 이 과정은 전기를 사용하여 자발적으로 발생하지 않는 화학 반응을 주도합니다.
* 설정 : 알루미늄 산화 알루미늄은 용융 냉동암 욕 (나트륨, 알루미늄 및 불소의 혼합물)에 용해된다. 이 혼합물은 전해질로서 작용하여 전기가 흐르도록합니다. 흑연 전극이 사용되며, 하나는 양극 (양수)으로, 다른 하나는 음극 (음성)으로 사용됩니다.
* 과정 : 전류가 용융 혼합물을 통과하면 다음이 발생합니다.
음극에서 * : 알루미늄 이온 (Al³⁺)은 전자를 얻고 액체 알루미늄 금속을 형성하도록 감소된다. (al³⁺ + 3e⁺ → al)
* 양극에서 : 산소 이온 (o²⁻)은 전자를 잃고 산화되어 산소 가스를 형성합니다. (2o²→ → o₂ + 4e⁻)
* 결과 : 액체 알루미늄 금속은 전해 세포의 바닥에서 수집된다.
키 포인트 :
* 전기 분해는 에너지 집약적이지만 알루미늄과 같은 반응성 금속을 추출하는 가장 효율적인 방법입니다.
* Hall-Héroult 공정은 전기 분해를 사용한 알루미늄 생산을위한 표준 산업 방법입니다.
Hall-Héroult 프로세스에 대한 자세한 내용을 원하시면 알려주세요!