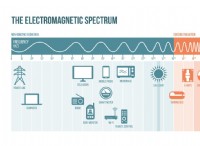
다음은 고장입니다.
* 고귀한 가스 주기율표의 그룹 18의 요소 (He, NE, AR, KR, XE, RN)입니다. 그것들은 전자의 외부 껍질을 갖는 안정성과 반응성 부족으로 유명합니다.
* 전자 구성 원자의 궤도에서 전자의 배열을 설명합니다.
* isoelectronic 동일한 수의 전자가 있음을 의미합니다.
어떻게 이런 일이 일어나나요?
원자는 안정적인 고귀한 가스 구성을 달성하기 위해 전자를 얻거나 잃을 수 있습니다. 이 과정은 이온화 로 알려져 있습니다 그리고 이온 (하전 된 원자)을 생성 할 수 있습니다.
예 :
* 나트륨 (NA) 가장 바깥 쪽 쉘에 전자가 하나 있습니다. 그 전자를 잃어들면, 그것은 나트륨 이온 (Na+) 가됩니다. neon (ne) 와 동일한 전자 구성으로 . 따라서, Na+는 NE와 동작이다.
* 염소 (CL) 가장 바깥 쪽 껍질에 7 개의 전자가 있습니다. 하나의 전자를 얻음으로써 클로라이드 이온 (Cl-) 가됩니다. Argon (AR) 와 동일한 전자 구성을 사용합니다 . 따라서, Cl-는 AR과 동일 전자이다.
키 포인트 :
* 등 전자 종은 동일한 수의 전자와 동일한 전자 구성을 갖습니다.
* 고귀한 가스를 갖는 등전자 인 원자 또는 이온은 일반적으로 더 안정적입니다.
*이 개념은 화학적 결합과 요소의 반응성을 이해하는 데 중요합니다.
등 전자 종의 개념을 이해함으로써, 우리는 원자가 어떻게 화합물을 상호 작용하고 형성하는지 더 잘 예측할 수 있습니다.