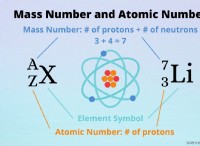
몰 용해도 및 pH 이해
* 어금니 용해도 : 염의 몰 용해도는 주어진 온도에서 포화 용액에서 금속 양이온 (또는 음이온)의 농도이다.
* pH : pH는 용액의 산도 또는 기본성을 측정합니다.
pH가 용해도에 미치는 영향
용액의 pH는 약산 또는 염기를 포함하는 염의 용해도에 영향을 줄 수 있습니다. 이는 용해 반응의 평형이 H+ 또는 옴의 존재에 의해 이동 될 수 있기 때문이다.
소금 분석
각 소금을 살펴 보겠습니다.
* NA3PO4 (인산 나트륨) : 인산 이온 (Po43-)은 약산 (H3PO4)의 컨쥬 게이트 염기이다. 산성 용액에서, H+ 이온은 PO43-와 반응하여 H3PO4를 형성하여 용해 평형을 오른쪽으로 이동시켜 용해도를 증가시킨다. 기본 솔루션에서, 정리는 용해도에 최소한의 영향을 미칩니다.
* NAF (불화 나트륨) : 불소 이온 (F-)은 약산 (HF)의 컨쥬 게이트 염기이다. 인산염과 유사하게, NAF의 용해도는 H+와 F-의 반응으로 인해 산성 용액의 증가가 될 것이다.
* kno3 (질산 칼륨) : 질산염 이온 (NO3-)은 강산 (HNO3)의 컨쥬 게이트 염기이다. 강산/염기는 접합체 염기의 용해도에 영향을 미치지 않으므로 pH는 KNO3의 용해도에 영향을 미치지 않습니다.
* Alcl3 (클로라이드 알루미늄) : 염화 알루미늄은 약산 또는 염기를 포함하지 않습니다. pH는 용해도에 크게 영향을 미치지 않습니다.
* Mns (망간 (II) 황화물) : 황화물 이온 (S2-)은 약산 (H2S)의 컨쥬 게이트 염기이다. MNS의 용해도는 H+와 S2-의 반응으로 인해 산성 용액의 증가가 될 것이다.
결론
몰 용해도가 용액의 pH에 의해 영향을받는 소금은 다음과 같습니다.
* NA3PO4 (인산 나트륨)
* NAF (불화 나트륨)
* MNS (망간 (II) 황화물)
중요한 참고 : 이들 염의 용해도는 산성 용액의 증가와 기본 용액의 감소가 될 것이다.