불안정한 요소는 일반적으로 전자를 잃거나 얻거나 공유하여 다른 요소와 결합합니다. 이것은 화학적 결합이라고합니다. 일반적으로 요소는 원자가 전자의 도움과 만 다른 요소와 결합됩니다. 원자가 전자는 원자의 가장 바깥 쪽 쉘에 존재하는 전자입니다. 이들은 핵에서 멀리 떨어져 있으며 다른 요소와의 결합에 쉽게 관여 할 수 있습니다.
하이브리드 화는 에너지가 다른 중심 원자의 원자 궤도의 혼합과 동일한 모양과 에너지의 동일한 수의 하이브리드 궤도에 대한 재분배를 포함하는 현상입니다. 혼성화는 중앙 원자에서만 발생합니다. 공유 분자에서, 높은 원자가를 갖는 요소는 중심 원자로 간주된다.
혼성화의 목적
하이브리드 화는 공유 분자와 중앙 원자의 원자 궤도 사이에서 발생합니다. 혼성화는 모든 공유 분자에서 발생하지 않으며 메탄, 암모니아 등과 같은 이종성 분자에서 발생합니다. 하이브리드 화는 중심 원자에서 발생하며, 원자가 껍질의 전자가 다른 에너지와 모양의 궤도에 존재합니다.
.혼성화의 중요성
하이브리드 화는 동일한 에너지의 궤도를 얻기 위해 중앙 원자에서 발생하며, 동일한 에너지로 궤도의 겹치는 것이 효과적입니다. 혼성화는 두 요소 사이에 형성된 채권의 유형을 아는 데 도움이됩니다. 공유 결합 원자 사이에 형성된 결합은 시그마 본드와 PI 결합의 두 가지 유형 일 수 있습니다.
시그마 본드 :시그마 본드는 궤도에 존재하는 전자의 공유에 의해 형성된 공유 결합이다. 궤도 사이에서 관찰되는 겹치는 유형은 정면 겹치거나 축 간 중첩입니다. 이러한 유형의 겹치는 겹치는 겹치는 궤도의 강한 중첩으로 이어지고, 따라서 최소 에너지를 가진 안정적인 결합입니다.
.pi bond :pi bond는 궤도에 존재하는 전자의 공유에 의해 형성된 공유 결합입니다. 궤도 사이에서 관찰되는 겹치는 유형은 옆으로 겹치거나 평행 한 중첩입니다. 옆으로 겹치는 것은 높은 에너지와 안정성이 낮은 결합이 약해집니다.
Sigma Bond는 더 강한 결합이며 독립적으로 존재할 수 있지만 Pi 결합은 약하고 독립적으로 존재할 수 없습니다.
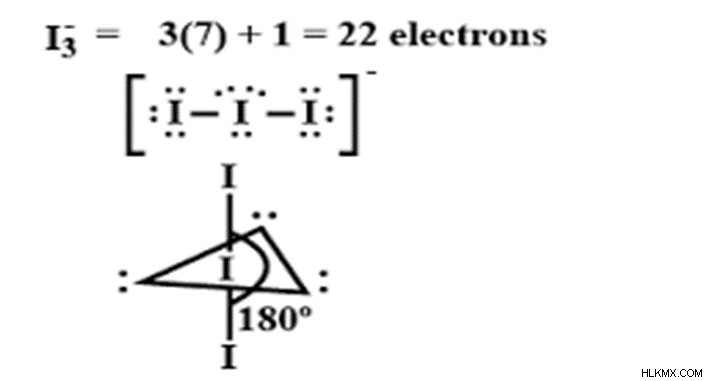
트리오 오드 이드 이온에서의 하이브리드 화
트리오 오디 이드 이온은 공식 (i3-)을 갖는 요오드 화합물이다. 화합물의 이름은 -ide 용어로 끝납니다. 이는 이진 화합물과 음이온임을 의미합니다. 이 이온은 선형적이고 대칭입니다. 이 화합물에서 요오드는 중앙 원자이며 가장 바깥 쪽 쉘에 7 개의 전자가 있습니다.
i- 원자 번호 -53
밸런스 전자 구성 - [KR] 4D10 5S2 5P5
요오드는 할로겐 패밀리에 속하며 옥켓 구성보다 하나의 전자가 적습니다. 요오드는 5s, 5p 및 4D 궤도에 존재하는 7 개의 전자를 모두 사용하여 하이브리드 궤도를 형성합니다. I2 분자는 I2 분자가 수용체로서 작용하고 I- 전자 공여체로서 작용함으로써 형성된 선형 이온이다. i3-가 SP3 혼성화를 겪는 혼성화.
요소의 혼성화를 계산하기위한 공식 :
하이브리드 화의 수 =원자가 전자 + 1가 원자 + (음전하) - (양전하)/2
=7+ 2 + 1- 0/2 =10/2 =5
혼성화 번호가 5와 같으면 하이브리드 화는 sp3d입니다.
VSEPR (Valence Shell Electron Pair 반발) 이론에 따르면, 혼성화에 대한 숫자는 결합 쌍 및 고독한 쌍의 합으로 계산할 수 있습니다. i3-에서, I 주위의 결합 쌍의 수는 2이고 고독한 쌍의 수는 3입니다. 따라서, 고독한 쌍과 본드 쌍의 합은 2 + 3 =5이며, 이는 SP3D 혼성화입니다. SP3D 하이브리드 화의 경우, 5 개의 결합 쌍이 존재할 때 예상되는 기하학은 삼각형 이피라미드 형상이다. 트리오오다 사이드 이온에는 고독한 쌍과 결합 쌍이 있습니다. VSEPR 이론에 따르면, 원자가 쉘에 존재하는 전자 쌍은 반발을 겪습니다. 반발은 결합 쌍, 고독한 쌍 및 고독한 쌍 결합 쌍 사이에있을 수 있습니다. 결합 결합 쌍 반발은 덜 강하고 결합이 멀리 떨어져있을 때 결합 각도가 증가 할 수 있습니다. 고독한 쌍의 쌍 반발은 강하고 결합 각도가 감소합니다. 고독한 쌍 결합 쌍 반발은 강하지 만 고독한 쌍-고독한 쌍의 반발보다 적습니다. 반발 순서는
입니다Bond-Bond Pair Repulsions <고독한 쌍 결합 쌍 Repulsions <고독한 쌍- 론 페어 리퍼 션
트리오오다 사이드 이온에는 고독한 쌍의 쌍 쌍 반발, 고독한 쌍 결합 쌍 반발 및 결합 쌍 결합 쌍 반발이 있습니다. 따라서 분자는 원래 형상, 모양 및 결합 각도에서 벗어납니다. 예상되는 기하학은 삼각형 비 피라미드이며, 달성 된 모양은 선형입니다. SP3D 혼성화에 대한 예상 결합 각도는 120과 90이지만 선형 모양으로 인해 결합 각도가 180입니다.
결론
이온 결합은 전자를 잃거나 전자를 얻는 것, 즉 전자의 전달을 통해 원소가 결합 될 때 발생하는 결합입니다. 이러한 유형의 결합은 전기 음성이 다른 요소 또는 금속과 비금속 사이에서 발생합니다. 거의 동일한 전기 음성 또는 전기 음성 차이 차이가 적은 요소를 공유하여 공유 결합을 형성합니다.