극성 분자
* 고르지 않은 전하 분포 : 극성 분자는 전자 밀도의 고르지 않은 분포를 가지며, 이는 분자의 한쪽 끝에 부분 양전하 (Δ+)가 있고 다른 쪽 끝은 부분 음전하 (Δ-)를 전달한다는 것을 의미한다.
* 원인 : 이 불균형은 분자의 원자들 사이의 전기 음성 성 차이로 인해 발생합니다. 전기 음성은 전자를 유치하는 원자의 능력입니다. 결합의 한 원자가 다른 원자보다 전기 음성이면, 공유 전자를 더 가깝게 끌어 당겨 해당 원자에 부분 음전하와 덜 전기 음성 원자에서 부분 양전하가 생성됩니다.
* 예 : 물 (H₂O), 암모니아 (NH주), 에탄올 (ch₃ch₂oh), 염산 (HCL)
* 속성 :
* 더 높은 끓는점 : 극성 분자의 부분 전하는 강력한 쌍극자 쌍극자 상호 작용을 형성 할 수있게 해주므로 더 많은 에너지가 파손되어야합니다.
* 극성 용매의 용해도 : 극성 분자는 용매 분자와의 강한 상호 작용을 형성 할 수 있기 때문에 극성 용매 (물과 같은)에 잘 녹입니다.
* 수소 결합을 형성하는 능력 : 수소 결합은 수소가 산소 나 질소와 같은 고도로 전기 음성 원자에 결합 될 때 발생하는 특히 강한 유형의 쌍극자-쌍극자 상호 작용입니다.
비극성 분자
* 고소 분포 : 비극성 분자는 전자의 균형 잡힌 분포를 가지므로 국소화 된 양전하 또는 음전하의 영역은 없습니다.
* 원인 : 이것은 일반적으로 분자의 원자가 유사한 전기성을 가질 때 또는 분자가 대칭 모양을 가질 때, 잠재적 극성을 취소 할 때 발생합니다.
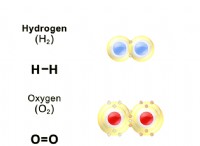
* 예 : 메탄 (ch,), 이산화탄소 (CO₂), 산소 (O₂), 헬륨 (HE)
* 속성 :
* 끓는 지점 : 비극성 분자는 극성 분자보다 약한 분자간 힘 (van der waals forces)을 가지므로 분리 할 에너지가 적습니다.
비극성 용매에서의 용해도 : 비극성 분자는 유사한 분자간 력으로 인해 비극성 용매 (오일 또는 헥산과 같은)에 잘 녹입니다.
* 일반적으로 수소 결합을 형성 할 수 없습니다.
주요 차이 : 쌍극자 모멘트의 존재 또는 부재 (전하 분리의 측정)는 극성 및 비극성 분자를 구별합니다. 극성 분자는 쌍극자 모멘트를 갖는 반면, 비극성 분자는 쌍극자 모멘트가 0입니다.
요약 : 극성 분자와 비극성 분자의 차이는 전자 밀도의 고르지 않은 (극) 또는 심지어 (비극성) 분포이며, 다른 분자와의 상호 작용과 관련된 특성 및 물리적 행동과 관련된 별개의 특성을 초래합니다.