* 비등점 고도 : 용액의 끓는점은 순수한 용매의 끓는점보다 높습니다 (이 경우 물). 이 현상을 끓는점 고도라고하며 공동 속성으로, 이는 동일성이 아니라 존재하는 용질 입자의 수에만 의존한다는 것을 의미합니다.
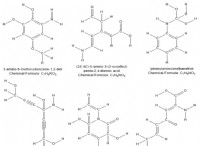
* 해리 : KOH와 KCL은 모두 강한 전해질이므로 물에 용해 될 때 이온으로 완전히 분리됩니다.
* KOH → Kh + OH태
* KCl → K→ + CL⁻
* van't Hoff accasion (i) : Van't Hoff 인자는 용질이 분리하는 이온의 수를 나타냅니다. KOH와 KCL은 각각 2 개의 이온을 생산하기 때문에 2 van't hoff 계수 2 를가집니다.
* 주요 차이 : 둘 다 동일한 몰이와 반'R 호프 인자를 가지지 만, KOH는 수산화 이온 (OHA)을 생성하며, 이는 클로라이드 이온 (CL)보다 더 강한 염기입니다. 수산화물 이온과 물 분자 사이의 더 강한 상호 작용은 염화물 이온과 물 사이의 약한 상호 작용에 비해 끓는점의 더 큰 상승을 초래한다.
요약 : 두 용액이 동일한 몰 리티브 및 반 아니오 호프 인자를 가지지 만, KOH 용액에서 수 분자 이온과 수산화물 이온의 더 강한 상호 작용은 KCl 용액에 비해 더 높은 끓는점을 초래한다.