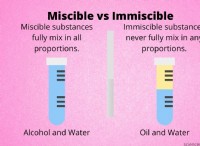
fe (no () ₃ (aq) + 3Na₂so₄ (aq) → fe₂ (so₄) ₃ (aq) + 6nano (aq)
방정식의 균형을 잡는 방법은 다음과 같습니다.
1. 반응물과 생성물을 식별하십시오 :
- 반응물 :철 (III) 질산염 (Fe (NOIT) ₃) 및 황산나트륨 (NAASOA)
- 제품 :철 (III) 설페이트 (Fe₂ (So₄) ₃) 및 질산 나트륨 (나노 ₃)
2. 불균형 방정식을 작성하십시오 :
-e (no₃) ₃ + na₂so₄ → fe₂ (so₄) ₃ + nano₃
3. 금속의 균형 :
- 생성물 측면에는 2 개의 Fe 원자가 있고 반응물 측에는 1 개의 Fe 원자가 있습니다. Fe (No₃) 앞에 2의 계수를 추가하십시오.
-2FE (NOIT) ₃ + na₂so₄ → fe₂ (so₄) ₃ + nano₃
4. 황산염 이온의 균형 (so₄²⁻) :
- 제품쪽에는 3 개의 So₄² 3 이온이 있고 반응물 측에는 1 개의 이온이 있습니다. na₂so₄ 앞에 3의 계수를 추가하십시오.
-2FE (NOIT) ₃ + 3NASOAT → FE₂ (so₄) ₃ + nano₃
5. 질산염 이온의 균형 (No₃⁻) :
- 반응물쪽에는 6 개의 NO 이온이 있고 제품 측에는 1이 있습니다. 나노 앞에 6의 계수를 추가하십시오.
-2FE (NOIT) ₃ + 3NA → FE₂ (SO₄) ₃ + 6NANO₃
6. 모든 요소 균형이 있는지 확인하십시오 :
-FE :양쪽에 2
-N :양쪽에 6
-O :양쪽에 18
-NA :양쪽에 6
-S :양쪽에 3
이제 방정식이 완전히 균형을 이룹니다.