오해 균질 한 용액을 형성하기 위해 완전히 혼합하는 두 물질의 특성입니다. 일반적 으로이 용어는 액체 혼합물을 설명하는 데 사용되지만 고체 및 가스에도 적용됩니다.
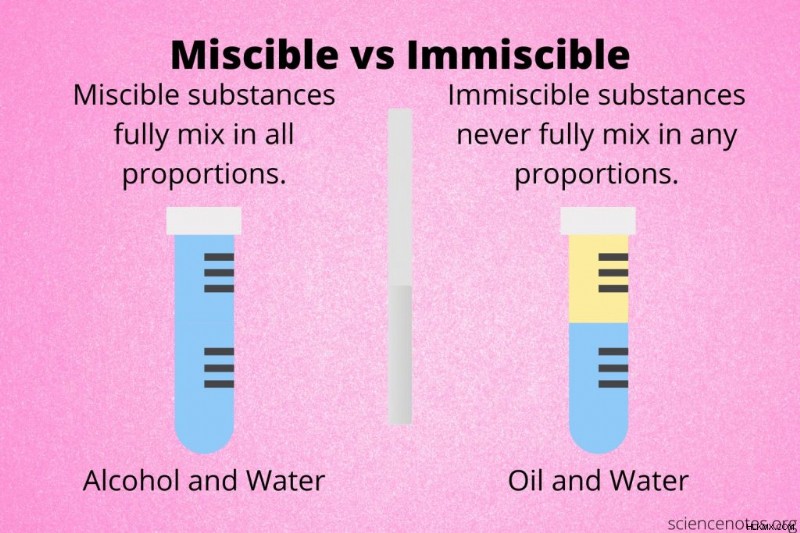
두 물질은 miscrible 입니다 그들이 모든 비율이나 농도를 혼합하여 용액을 형성하는 경우. 다시 말해, 동일하게 혼합하는지 아니면 한 구성 요소가 다른 구성 요소보다 더 많은 양으로 존재하는지 여부는 중요하지 않습니다.
두 가지 물질은 비밀화 입니다 그들이 솔루션을 형성하기 위해 완전히 혼합하지 않으면. 결합되면, 불가능한 물질은 층으로 분리되거나 이종 혼합물을 형성합니다.
혼잡한 혼합물의 예
에탄올과 물은 혼잡 한 액체입니다. 어떤 비율이 혼합되어 있더라도 솔루션을 형성합니다. 벤젠과 아세톤은 혼잡합니다. 헥산과 자일 렌은 혼잡합니다.
모든 가스는 정상적인 압력으로 서로 오해 할 수 있습니다. 예를 들어, 헬륨 및 질소 가스는 혼잡합니다. 공기와 아르곤은 혼잡합니다. 에탄올 증기와 수증기는 혼잡합니다.
무관 한 고체는 액체 용융물로부터 형성 된 다음 굳어지기 때문에 약간 다르게 작동합니다. 합금을 형성하는 요소는 무관합니다. 따라서 철과 탄소는 (강철을 만들기 위해) 혼화 가능합니다. 구리와 아연은 놋쇠를 만들기 위해 혼잡합니다. 오해는 또한 미네랄을 생성합니다. 예를 들어, 올리 빈 [(mg, fe)
비도성 혼합물의 예
오일과 물은 비밀리에 액체의 전형적인 예입니다. 기름과 물을 혼합 할 수는 있지만 분리됩니다. 다른 불가능한 액체는 물과 벤젠, 물과 톨루엔, 메탄올과 시클로 헥산입니다.
모든 가스는 정상 압력에서는 잘못된 것이지만 가스 가스의 비도성은 고온과 압력에서 발생할 수 있습니다. 이러한 조건에서 압축 입자는 액체와 비슷하지만 온도는 임계 온도를 초과합니다. 예를 들어, 벤젠 증기와 수증기는 고압으로 비밀화 할 수 없게됩니다.
합금을 형성하지 않는 고형물은 불가능한 고체의 예입니다. 그들은 액체로 혼합 될 수 있지만 응고시 분리됩니다. 예를 들어, 구리와 코발트는 비밀리에있는 고체입니다.
부분적으로 잘못된 혼합물
기술적으로, 오해는 흑백입니다. 두 물질은 혼화되거나 그렇지 않습니다. 그러나 비도성 수준이 있습니다. 일부 용매는 특정 비율로 서로가 용해됩니다. 다른 경우에는 한 구성 요소 중 하나가 거의 혼합되지 않은 상태로 남아 있습니다. 예를 들어, 부타 논은 부타 논이 물에 크게 용해 되더라도 모든 비율에 용해되지 않기 때문에 부타 논 (메틸 에틸 케톤)과 물이 비록 불가능합니다.
오해 식별
일반적으로 결과를 살펴보면 두 개의 액체가 혼잡한지 알 수 있습니다. 불완전한 액체는 맑은 액체를 생성하는 반면, 비활성 액체는 흐린 또는 층 혼합물을 생성한다. 그러나 두 액체가 동일한 색상 및 유사한 굴절 지수를 갖는 경우 층을보기가 어려울 수 있습니다. 무관 한 고체는 균질 한 고체를 형성합니다. 불가능한 고체는 완전히 분리되거나 이질적인 것처럼 보입니다.
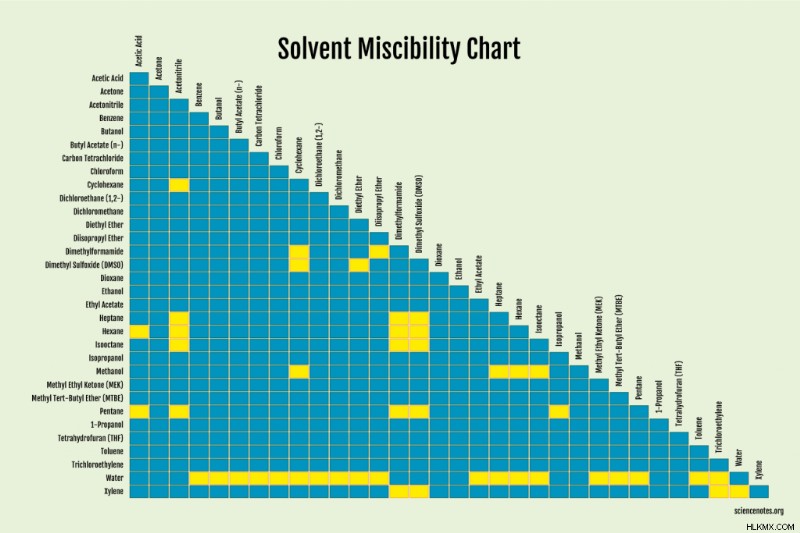
용매의 경우 액체가 혼잡한지 간단히 찾는 것이 가장 쉽습니다.
오해를 결정하는 요인
몇 가지 요인이 오해에 영향을 미칩니다. 비슷한 극성을 가진 물질은 고통스러운 경향이 있습니다. 다시 말해서,“처럼 녹는 것 같아요.” Van der Waals의 힘에 의해 함께 보유 된 비극성 용매는 극성 용매 분자의 더 강한 결합을 극복 할 수 없으며 그들 사이에 섞여 혼합 할 수 없습니다. 따라서, 극성 용매는 전형적으로 다른 극성 용매와 혼합되는 반면, 비극성 용매는 일반적으로 다른 비극성 용매와 혼합됩니다. 예외가 있으므로 다른 요소가 작용합니다.
탄화수소 사슬의 중량 백분율은 유기 화합물이 물로 상사되는지 여부를 결정합니다. 에탄올에는 두 개의 탄소 원자가 있으며 물로는 혼잡합니다. 대조적으로, 1- 부탄올은 4 개의 탄소 원자를 가지고 있으며 물에 비해 비 침해됩니다.
혼합물이 구성 요소보다 구성 엔트로피가 낮 으면 폴리머가 서로 혼합되는 경향이 있습니다.
오해와 용해도의 차이
오해와 용해도는 관련 개념입니다. 이들 사이의 가장 큰 차이점은 오해가 같은 단계에서 두 개의 액체 또는 2 개의 가스와 같은 두 성분의 혼합물을 설명한다는 것입니다. 용해도는 설탕 (고체) 및 물 (액체)과 같은 두 가지 상이있는 두 단계의 혼합물에서 발생하는 일을 설명 할 수있는보다 일반적인 개념입니다. 용해도는 한 성분 (용질)이 다른 성분 (용매)에 용해되는 능력입니다. 물론, 용질과 용매가 동일한 단계 인 혼합물에 용해도가 적용될 수있다. 무관 한 액체는 모든 농도에서 용해됩니다.
참조
- Gilbert, John C.; Martin, Stephen F. (2010). 실험 유기 화학 :미니 스케일 및 마이크로 스케일 접근 방식 . Cengage Learning. ISBN 978-1439049143.
- Rowlinson, J.S.; Swinton, F. L. (1982). 액체 및 액체 혼합물 (제 3 판). 화학의 버터 워스 논문.
- Stephen, H.; Stephen, T. (2013). 이진 시스템 :무기 및 유기 화합물의 용해도 . 볼륨 1p1. elsevier. ISBN 9781483147123.
- Wade, Leroy G. (2003). 유기 화학 . 피어슨 교육. 피. 412. ISBN 0-13-033832-X.