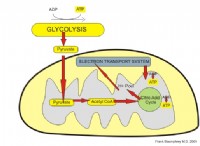
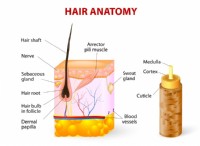
일반 트렌드 :
* 알칼리성 지구 금속 (그룹 2) : 같은 기간 내에 알칼리 금속 (그룹 1)보다 밀도가 높습니다.
* 밀도는 그룹을 낮추고 알칼리와 알칼리성 지구 금속은 그룹을 아래로 이동함에 따라 (LI에서 CS로, 또는 RA로) 밀도가 증가합니다.
차이에 대한 이유 :
1. 원자 크기와 양성자 수 :
* 알칼리 금속 : 원자가 전자를 당기는 양성자가 적기 때문에 더 큰 원자 반경을 갖습니다.
* 알칼리성 지구 금속 : 원자가 전자를 추가로 당기기 때문에 더 작은 원자 반경을 갖습니다. 이 더 강한 매력은 원자의 밀도가 높은 포장으로 이어집니다.
2. 원자가 전자 수 :
* 알칼리 금속 : 원자가 전자가 하나 있습니다.
* 알칼리성 지구 금속 : 두 개의 원자가 전자가 있습니다. 추가의 전자는 더 강한 금속 결합에 기여하여 더 밀도가 높습니다.
예 :
* 리튬 (li) : 밀도 =0.534 g/cm³
* 베릴륨 (be) : 밀도 =1.85 g/cm³
두 요소 모두 같은 기간이지만 알칼리성 지구 금속 인 베릴륨은 위에서 설명한 이유로 인해 훨씬 밀도가 높습니다.
결론 :
같은 기간에 알칼리 금속과 비교하여 알칼리성 지구 금속의 밀도는 주로 원자 크기가 작고, 더 강한 금속 결합 및 더 많은 양의 양성자로 인한 것입니다.