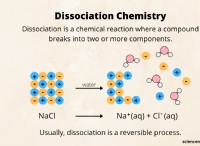
다음은 고장입니다.
* 단일 화살표 (→) : 이것은 A 전방 반응을 나타냅니다 , 반응물이 생성물로 변환되고 있음을 의미합니다.
* 예 :2H₂ + OAT → 2H₂O (수소와 산소는 물을 형성하기 위해 반응)
* 이중 화살표 (⇌) : 이것은 가역적 반응을 나타냅니다 , 반응은 양방향으로 진행될 수 있음을 의미합니다 - 반응물을 형성하는 반응물 및 반응물을 형성하는 생성물. 화살표는 어떤 방향이 선호되는지 보여주기 위해 길이가 다를 수 있습니다.
* 예 :n 3 + 3H₂ ⇌ 2NH₃ (질소와 수소는 암모니아를 형성하기 위해 반응 할 수 있으며 암모니아는 다시 질소와 수소로 분해 될 수 있습니다)
추가 정보 :
* 화살촉 : 화살촉은 제품을 가리 킵니다.
* 반응 조건 : 화살표에는 열 (δ), 촉매 (PT) 또는 압력 (압력)과 같은 반응 조건을 나타내는 것을 나타내는 위 또는 아래의 기호를 동반 할 수 있습니다.
* 반응 메커니즘 : 때로는 여러 화살표가 일련의 단계를 통해 반응이 발생하는 복잡한 반응 메커니즘을 나타 내기 위해 사용됩니다.
요약하면, 화학 반응의 화살표는 화학적 형질 전환의 방향과 반응물이 생성물로 변환되는 방법을 이해하는 데 도움이되는 중요한 구성 요소입니다.