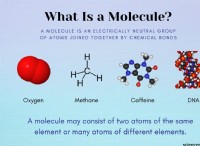
1. 루이스 구조 :
* 탄소 (C)에는 4 개의 원자가 전자가 있습니다.
* 요오드 (I)에는 7 개의 원자가 전자가 있습니다.
안정적인 옥셋을 달성하기 위해, 탄소는 4 개의 요오드 원자로 4 개의 단일 결합을 형성한다. 루이스 구조는 다음과 같습니다.
나
|
i -c -i
|
나
2. 전자 도메인 형상 :
* 중앙 원자 : 탄소
* 중앙 원자 주위의 전자 도메인 수 : 4 (각 단일 결합은 하나의 전자 도메인을 나타냅니다)
VSEPR 이론에 따르면, 중앙 원자 주변의 4 개의 전자 도메인은 사면체로 이어진다. 전자 도메인 형상.
3. 분자 형상 :
* 4 개의 전자 도메인 모두 결합 쌍 (단일 결합)이므로 분자 형상은 전자 도메인 형상과 동일합니다. .
따라서 탄소 테트라 요오드 라이드 (CI₄)의 형태는 사면체입니다.