Aufbau 원칙은 무엇입니까?
Aufbau 원리는 전자가 먼저 중성 원자에서 가장 낮은 에너지 전자 쉘을 채울 것이라고 명시하고 있습니다. 전자는 가장 낮은 에너지 궤도에서 가장 높은 에너지 궤도까지의 궤도를 채 웁니다. Aufbau 원리는 원자의 전자 구조를 결정하는 데 도움이됩니다.
일반 순서 쉘은 1, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s입니다. 이 순서는 또한 아래에서 시각적으로 표시됩니다.
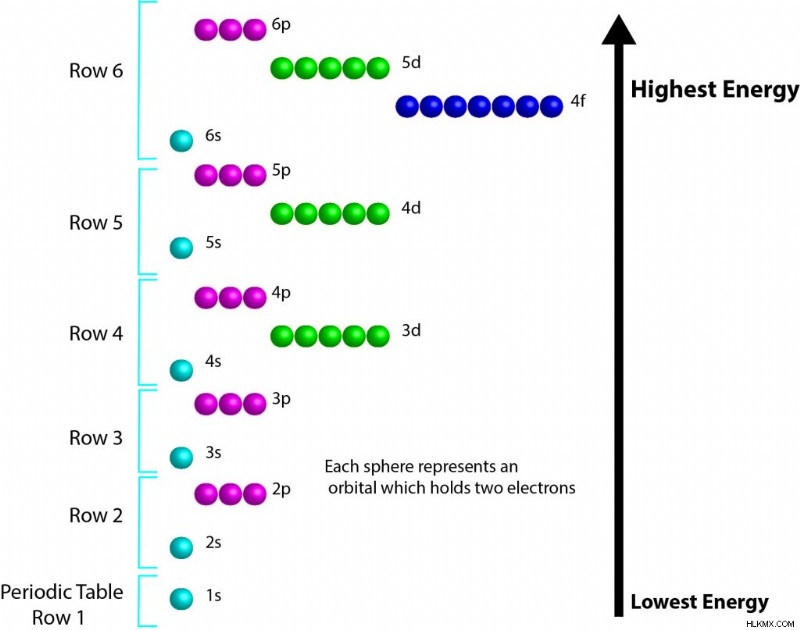
d- 및 f- 궤도의 순서를 기억하려고 할 때 몇 가지 패턴을 알아 차리는 것이 도움이 될 수 있습니다. P- 및 S- 궤도는 항상 행과 동일한 원리 에너지 수준 번호를 갖습니다. D- 블록이 수행되면 원리 에너지 수준 번호는 항상 행 번호 또는 S- 블록의 값보다 하나가됩니다. F- 블록의 경우 원리 에너지 수준 수는 항상 현재 행보다 2가 적습니다. 이 개념의 유용한 다이어그램은이 페이지에 전자 구조에 있습니다. 상대 에너지를 시각화하는 다른 방법은 여기에서 찾을 수 있습니다.
S 쉘은 두 개의 전자를 담을 수 있습니다. P 레벨은 6 개의 전자를 보유 할 수 있습니다. D 레벨은 10 개의 전자를 보유 할 수 있습니다. 그리고 마지막으로, f 궤도는 최대 14 개의 전자를 보유하고 있습니다.
궤도를 채울 때는 Pauli 배제 원칙과 헌드의 규칙도 따라야합니다.
aufbau라는 단어는 독일어 up 에서 나온 것입니다. 또는 구조 . 원자의 전자는 가장 낮은 에너지 수준에서 가장 높은 에너지 수준으로 구축되어야합니다.
Madelung Rule
다음에 어떤 궤도가 채워질 지 결정하는 또 다른 방법은 n 의 값을 사용하는 것입니다. + l . n은 원칙 에너지 수준 또는 원리 양자 수입니다. l 궤도 유형 또는 방위각 양자 수 - S =0, p =1, d =2 및 f =3입니다. 어느 쪽이든 궤도가 가장 낮은 n + l 가치가 먼저 채워집니다. 두 궤도가 같은 값을 갖는 경우 N 값이 낮은 값이 먼저 채워집니다.
Aufbau 규칙에 대한 예외
Aufbau 원칙에는 몇 가지 예외가 있습니다. 이들은 주로 주기적 표의 D- (전이 금속) 및 F- (란타니데이드 및 액티 나이드) 블록의 원자에서 나온다. 예외는 일반적으로 원자 수가 40보다 큰 요소에서 나옵니다. 이러한 예외는 절반과 완전히 채워진 궤도에서 안정성이 증가하여 원자의 전체 에너지를 낮추기 때문에 발생합니다. 이러한 경우 전자가 서로 멀어 질 수 있기 때문에 안정성이 증가합니다. 또한, 궤도 사이의 에너지 차이는 더 높은 원자 수에서 더 작습니다.
예외가있는 요소 중 일부 :
- 크롬 (CR)은 예상되는 [AR] 3D4 대신 [AR] 3D4S가됩니다. 부분적으로 채워진 궤도에 반으로 가득 찬 궤도를 갖는 안정성이 증가하기 때문입니다.
- 구리,은 및 금 (모두 11 열)은 모두 d 궤도에 들어가는 궤도에있을 것으로 예상되는 전자가 있습니다.
- 이것들은 몇 가지 예외이며, 예외가있는 다른 요소 중 일부는 팔라듐, 몰리브덴, 로듐 및 백금입니다.
또한, 전자는 Aufbau 규칙에 따라 항상 최고 에너지 쉘에서 원자를 남겨 두는 것은 아닙니다. 전자가 떠날 때 원자는 이온이되고 Aufbau 규칙은 더 이상 적용되지 않습니다.
예 전자 구성 aufbau 원칙 사용
탄소 전자 구성
원자의 탄소 수는 6이므로 탄소에는 6 개의 전자가 있습니다. Aufbau 원리에 따르면, 우리는 2 개의 전자를 보유한 가장 낮은 에너지 쉘 (1)에서 채우기 시작합니다. 이제 4 개의 전자가 남아 있습니다. 두 개의 전자가 다음 2S 궤도로 들어갑니다. 나머지 두 개의 전자는 2P 궤도로 들어갑니다. 기록 된 전자 구성은 1S2S2p입니다.
입니다칼슘 전자 구성
칼슘의 원자 수는 20이므로 칼슘에는 20 개의 전자가 있습니다. 쉘을 껍질을 20 개로 계산하는 대신 단순화 할 수 있습니다. 우리는 첫 번째 쉘이 2 개의 전자를 보유하고 있음을 알고 있습니다. 다음 쉘은 8 개의 전자를 보유합니다. 그것은 우리에게 10 개의 전자를 남겨 두었습니다. 이것은 속기 전자 구성 방법을 사용하는 것과 유사합니다. 지금까지 우리는 Neon (Link)의 고귀한 가스 구성을 작성했습니다. 칼슘은 네 번째 줄에 있으므로 아르곤의 고귀한 가스 구성으로 뛰어들 수 있습니다. 그 후 우리는 2 개의 전자가 남았습니다. 다음으로 가장 낮은 에너지 쉘은 4S입니다.
칼슘의 전자 구성은 1S2S2P3S3P4 또는 [AR] 4S입니다.
브롬 전자 구성
Bromine은 주기율표의 네 번째 줄에 있으며 원자 수가 35입니다. 위의 다이어그램을 사용하여 최대 35 개의 전자를 계산할 수 있습니다. 행 1은 우리에게 두 개의 전자를 제공합니다. 행 2는 3 행과 마찬가지로 8 개의 전자를 제공합니다. 이는 총 18 개의 전자와 Argon (AR)의 전자 구성입니다. 그런 다음 4 행을 가로 지르는 길을 가로 지르며, 4S는 먼저 D- 블록을 얻습니다. D- 블록은 원칙 에너지 번호가 3입니다. Bromine에 계산하면 p- 블록에 5 개의 전자가 있음을 보여줍니다.
.따라서 전자 구성은 1S2S2P3S3P4S 3D4P 또는 [AR] 4S 3D4P.
입니다.관련 자습서
- 전자 쉘 구성
- 헌드의 규칙
- 주기적인 테이블 이해
- 양자 수와 궤도 형태
- 전자 궤도