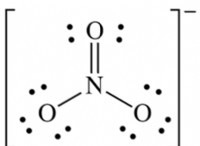
1. 화학 반응 :
* Co₂는 물과 반응합니다 : Co₂은 물에 용해되는 것이 아닙니다. 그것은 물 분자와 반응하여 탄산산 (H₂Co₃)을 형성합니다. 이 반응은 가역적이지만, 탄산의 형성은 물에서 COS의 전반적인 용해도를 상당히 증가시킨다.
* o₂는 물과 반응하지 않습니다 : 산소는 새로운 화학 종을 형성하지 않고 간단한 물리적 과정을 통해 물에 용해됩니다.
2. 분자 특성 :
* 극성 : COS는 탄소와 산소 사이의 전기 음성 성 차이로 인해 약간 극성을 갖는 선형 분자이다. 이를 통해 물 분자와 약한 쌍극자 쌍극자 상호 작용을 형성 할 수 있습니다. 비극성 분자 인 산소는 물과의 상호 작용을 위해 약한 런던 분산 힘에만 의존합니다.
* 크기와 모양 : Co₂는 O₂보다 작은 분자이며 더 컴팩트 한 모양을 가지고 있습니다. 이를 통해 물 분자 사이의 공간에 더 쉽게 맞출 수있어 용해도가 더욱 증가합니다.
3. 온도 및 압력 :
* 온도 : 가스의 용해도는 온도가 증가함에 따라 감소합니다. 그러나, COS의 물과의 반응에 관여하는 더 강한 분자간 힘으로 인해 COS보다 산소에 대한 효과가 더욱 두드러진다.
* 압력 : 가스의 용해도는 압력이 증가함에 따라 증가합니다. 이것은 co both와 o₂ 모두에게 해당됩니다.
요약 :
O₂와 비교하여 물에서 COS의 가용성이 높을수록 주로 다음과 같습니다.
* 물과의 화학 반응 : Co₂는 물과 반응하여 탄산을 형성하여 용해도를 증가시킵니다.
* 극성 : COS의 약간의 극성은 비극성 O₂와 비교하여 물 분자와 더 강한 상호 작용을 허용합니다.
* 크기와 모양 : Co₂는 더 작고 더 컴팩트하여 물 분자 사이의 공간에 더 잘 맞도록합니다.
OT는 호흡 및 기타 생물학적 과정에 필수적이지만, COS의 가용성이 높을수록 혈액에서 COS의 수송과 수생 환경에서 pH를 조절하는 데있어서의 역할에 중요하다.