불안정한 요소는 일반적으로 전자를 잃거나 얻거나 공유하여 다른 요소와 결합합니다. 이것은 화학적 결합이라고합니다. 일반적으로 요소는 원자가 전자의 도움과 함께 다른 사람들과 결합됩니다. 원자가 전자는 원자의 가장 바깥 쪽 쉘에 존재하는 전자입니다. 이것들은 핵에서 멀지 않으며 다른 요소와의 결합에 쉽게 관여 할 수 있습니다.
요소는 전자를 잃거나 전자를 얻는 전자를 얻음으로써 결합됩니다. 이러한 유형의 결합을 이온 결합이라고하며, 이는 전기 음성이 다른 원소 또는 금속과 비금속 사이에서 발생합니다. 거의 동일한 전기 음성 또는 전기 음성 차이 차이가 적은 요소를 공유하여 공유 결합을 형성합니다.
하이브리드 화 :
하이브리드 화는 중앙 원자의 원자 궤도의 혼합 현상으로, 에너지가 약간 다른데, 동일한 모양과 에너지의 동일한 수의 하이브리드 궤도에 대한 재분배. 혼성화는 중앙 원자에서만 발생합니다. 공유 분자에서, 높은 원자가를 갖는 요소는 중심 원자로 간주됩니다.
혼성화의 목적 :
하이브리드 화는 공유 분자와 중앙 원자의 원자 궤도 사이에서 발생합니다. 혼성화는 모든 공유 분자에서 발생하지 않지만 메탄, 암모니아 등과 같은 이종성 분자에서 발생합니다. 하이브리드 화는 중심 원자에서 발생하며, 원자가 껍질의 전자가 다른 에너지와 모양의 궤도에 존재합니다.
.혼성화의 중요성 :
하이브리드 화는 중앙 원자에서 발생하여 동일한 에너지를 갖는 궤도의 궤도가 동일한 에너지를 가진 궤도의 겹치는 것이 효과적입니다. 혼성화는 두 요소 사이에 형성된 채권의 유형을 아는 데 도움이됩니다. 공유 결합 원자 사이에 형성된 결합의 유형은 시그마 본드와 PI 결합의 두 가지 유형 일 수 있습니다.
시그마 본드 :시그마 본드는 궤도에 존재하는 전자를 공유함으로써 형성된 공유 결합이다. 궤도 사이에서 관찰되는 겹치는 유형은 정면 겹치거나 축 간 중첩입니다. 이러한 유형의 겹치는 것은 궤도가 강한 겹치게됩니다. 따라서 최소 에너지로 안정적 인 더 강한 결합이 형성됩니다.
pi bond :pi bond는 또한 궤도에 존재하는 전자를 공유함으로써 형성된 공유 결합이다. 궤도 사이에서 관찰되는 겹치는 유형은 옆으로 겹치거나 평행 한 중첩입니다. 옆으로 겹치는 것은 높은 에너지와 안정성이 낮은 결합이 약해집니다.
시그마 본드는 더 강한 결합이며 독립적으로 존재할 수 있지만 Pi 결합은 약한 결합이며 독립적으로 존재할 수 없습니다.
질산염의 혼성화 :
질산염 이온에는 공식이 있습니다 (NO3-). 이 이온은 알칼리 및 알칼리성 지구 금속의 많은 질산염 소금의 부정적인 부분입니다. 예는 질산 칼륨, 질산 마그네슘, 질산 칼슘 등을 포함한다. 분자 질산염 이온에서 질소 원자는 중심 원자이다. 산소 원자는 존재하지만, 질소는 O보다 전기 음성이 적기 때문에 중심 원자입니다. 이는 전자를 잃는 경향이 O보다 높고 N보다 더 큰 원자가를 갖는 것을 의미합니다.
.질산염 음이온에서, n 원자는 +5 산화 상태를 가지며, 산소는 -2 산화 상태를 나타낸다. 질소는 최초의 가장 전기 음성 요소이며 산소는 두 번째로 가장 전기 음성 요소입니다. 질소는 산소에 비해 전기 양성입니다. 질소는 3 개의 산소 원자로 둘러싸여 전자를 공유하여 공유 결합을 형성함으로써 결합됩니다.
중심 원자 N의 혼성화는 SP2 혼성화라고합니다. 요소의 하이브리드 화를 계산하는 공식은 여러 채권 쌍의 합과 고독한 쌍의 수입니다.
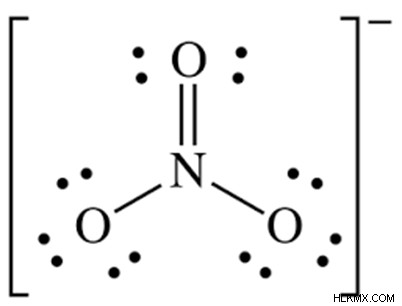
질산염 분자 이온 루이스 도트 구조에서 질소는 3 개의 시그마 결합과 제로 고독한 쌍으로 둘러싸여 있으며 옥켓 구성을 갖습니다. 각 산소는 8 개의 전자를 얻고 옥트 구성을 만족시킵니다.
질소 원자 번호 - 7
전자 구성 - 1S2 2S2 2P3
질소는 2s, 2px, 2py, 2pz 궤도를 사용하며 3 SP2 하이브리드 궤도를 형성합니다. 질소는 3 개의 SP2 하이브리드 궤도로 각 산소의 P 궤도와 겹칩니다. 질소에 남겨진 구조화되지 않은 p 궤도는 산소 원자의 p 궤도와 옆으로 겹치며 n과 O 사이의 PI 결합을 형성합니다. N의 혼성화는 SP2라고합니다. VSEPR 이론에 따르면, SP2 하이브리드 화를 갖는 화합물의 경우, 기하학은 삼각 평면이고, 결합 각은 120도이다.
질산염 분자에서 질소는 삼각형의 3 모서리 형태로 둘러싸인 3 개의 산소 원자가 있습니다. 분자의 모든 원자는 한 평면에 있고 분자는 평면이라고합니다. 질산염 이온에서, 질소는 이중 결합에 의해 산소에 결합되며 산소에 하나의 쌍과 산소에 대한 음전하가 있습니다. 이 음전하는 하나의 원자에만 존재하는 것이 아니라 분자 전체에 걸쳐 모든 원자로 이동하여 공명을 겪고 공명 에너지에 의해 안정화됩니다.







