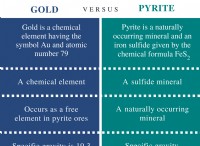
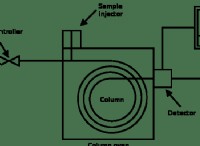
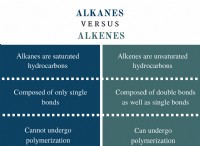
1. 균형 분자 방정식을 작성하십시오 :
al (OH) ₃ (S) + 3NAOH (aq) → na₃al (OH) ₆ (aq)
2. 완전한 이온 성 방정식을 작성하십시오 :
Al (OH) ₃ (S) + 3NA⁺ (aq) + 3oh⁻ (aq) → 3NA (aq) + [al (OH) ₆] ³⁻ (aq)
3. 관중 이온을 식별하고 취소하십시오 :
관중 이온은 방정식의 양쪽에 나타나지 않은 이온입니다. 이 경우 관중 이온은 na⁺입니다.
4. 순 이온 방정식을 작성하십시오 :
al (OH) ₃ (S) + 3OH⁻ (aq) → [al (OH) ₆] ³⁻ (aq)
설명 :
* 수산화 알루미늄 (Al (OH) ₃) 견고하기 때문에 이온으로 분리되지 않습니다.
* 수산화 나트륨 (NAOH) 용액에 완전히 분리되어 Na⁺ 및 OH 이온을 형성하는 강력한 기초입니다.
* 나트륨 알루미 네이트 (na₃al (OH) ₆) 용액에 존재하는 복잡한 이온입니다.
순 이온 성 방정식은 알루미늄 수산화물이 수산화 이온과 반응하여 테트라 하이드 록스 xoaluminate (III) 복합 이온, [al (OH) ₆] ³⁻을 형성 함을 보여준다.
키 포인트 :
* 과잉 Naoh : 반응은 복잡한 이온의 형성을 구동하기 위해 과도한 NaOH가 필요하다.
* 양서류 특성 : 수산화 알루미늄은 양서류이므로 산 및 염기와 반응 할 수 있습니다. 이 경우 산으로 작용하여 수산화물 이온을 수용합니다.
* 복잡한 이온 형성 : 반응은 복합 이온을 형성하는데, 이온은 리간드 (이 경우 수산화물 이온)로 둘러싸인 중앙 금속 이온을 함유하는 종이다.