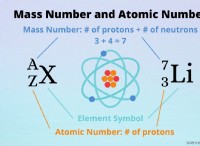
다음은 고장입니다.
* kh₂po₄ (칼륨 디 하이드로 겐 포스페이트) :
*이 소금은 본질적으로 산성입니다.
* 그것은 강한 염기 (KOH)와 약산 (h₃po₄)에서 형성됩니다.
* 용액에서, 그것은 디 하이드로 겐 포스페이트 이온 (H₂Po₄⁻)의 부분 해리로 인해 HAT 이온을 방출한다.
* 방출 된 HATION은 더 낮은 pH (산성)에 기여합니다.
* k₂hpo₄ (Dipotassium 수소 포스페이트) :
*이 소금은 본질적으로 기본입니다.
* 그것은 강한 염기 (KOH)와 약산 (h₃po₄)에서 형성됩니다.
* 용액에서, 그것은 수소 포스페이트 이온의 부분 해리로 인해 OH 이온을 방출한다 (HPO₄²⁻).
* 방출 된 OH 이온은 더 높은 pH (기본)에 기여합니다.
주요 차이 :
그들의 pH 값의 차이는 관련된 접합체 산-염기 쌍의 상대적 강도에서 비롯된다.
* kh₂po₄ : hionpo₄⁻ 이온은 hpo₄²⁻ 이온보다 더 강한 산이므로 더 많은 h⁺ 이온을 기증하여 pH를 더 낮 춥니 다.
* k₂hpo₄ : HPO⁻²₄ 이온은 HATOJ 이온보다 더 강한 기초이므로 더 많은 HALE 이온 (또는 더 많은 OH 이온을 기부)을 받아 PH가 더 높아집니다.
요약 :
이들 염의 용액의 pH는 해리에 관여하는 컨쥬 게이트 산-염기 쌍의 상대적 강도에 의해 영향을 받는다. Kh₂po acid는 더 강한 산 성분으로 인해 산성이며, K₂hpo₄는 더 강한 기본 성분으로 인해 기본입니다.