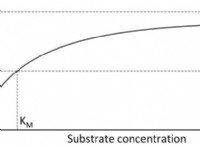
균형 화학 방정식은 다음과 같습니다.
cl a (aq) + 2NABR (aq) → 2NaCl (aq) + br₂ (aq)
설명 :
* 염소 (Cl₂)는 브로민 (br₂)보다 반응성이 높습니다. . 이것은 염소가 전자를 얻고 음성 이온을 형성하는 경향이 더 강하다는 것을 의미합니다.
* 염소가 브로마이드 나트륨 용액에 첨가 될 때, 염소 원자는 브로마이드 이온 (Br-)과 반응하여 브로민 분자 (BR) 및 클로라이드 이온 (Cl-)을 형성한다.
* 나트륨 이온 (Na+)은 염화나트륨 (NaCl)을 형성하여 용액에 남아 있습니다.
관찰 :
반응은 브라운-레드 용액 의 형성을 초래한다. 브롬의 존재로 인해. 용액은 또한 브롬의 약간 매운 냄새 특성을 가질 수있다.
중요한 참고 :
이 반응은 할로겐 변위 반응 의 전형적인 예입니다. . 할로겐 (그룹 17 요소)은 반응성이 높으며 반응성 경향에 따라 화합물로부터 서로 대체 할 수 있습니다.
* 불소 (f₂)> 염소 (Cl₂)> 브롬 (Bromine)> 요오드 (I주)> 아스타틴 (AT)
이것은 불소가 염소를 대체 할 수 있고, 염소가 브롬을 대체 할 수 있음을 의미합니다.