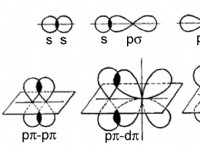
1. 원자가 전자 수
* Bromine (BR)에는 7 개의 원자가 전자가 있습니다.
* 산소 (O)에는 6 개의 원자가 전자가 있습니다.
* 음전하는 하나의 여분의 전자를 추가합니다.
* 총 원자가 전자 :7 + (4 * 6) + 1 =32
2. 중앙 원자를 결정하십시오
* Bromine (BR)은 가장 전기 음성 요소이며 중심 원자입니다.
3. 원자를 단일 결합으로 연결하십시오
* 4 개의 산소 원자를 단일 결합으로 브롬 원자에 연결하십시오. 이것은 8 개의 원자가 전자 (본드 당 4 개의 결합 * 2 개의 전자)를 사용합니다.
4. 나머지 전자를 고독한 쌍으로 분배하십시오
* 우리는 24 개의 원자가 전자가 남아 있습니다 (32 -8 사용).
* 산소 원자 주위에 고독한 쌍으로 배포하여 각 산소 원자에 3 개의 고독한 쌍 (6 개의 전자)을 제공합니다. 이것은 나머지 24 개 전자를 모두 사용합니다.
5. 옥트 규칙 이행을 확인하십시오
* 모든 산소 원자는 전체 옥셋을 갖는다 (단일 결합에서 2 개의 전자 + 고독한 쌍의 6 개).
* Bromine은 또한 전체 옥셋을 가지고 있습니다 (4 개의 결합에서 8 개의 전자).
6. 공식 전하 계산
* 공식 전하 =(원자가 전자) - (비 결합 전자) - (1/2 결합 전자)
* 브롬 (BR)에 대한 공식 전하 :
* 원자가 전자 =7
* 비 결합 전자 =0
* 본딩 전자 =8
* 공식 전하 =7-0- (8/2) =+1
* 산소 원자 중 하나에 대한 공식 전하 (O) :
* 원자가 전자 =6
* 비 결합 전자 =6
* 본딩 전자 =2
* 공식 전하 =6-6- (2/2) =-1
루이스 구조 :
```
영형
|
o -br -o
|
영형
```
공식 요금 :
* Bromine (BR) :+1
* 산소 (O) :-1
중요한 참고 : 공식 요금은 전자 분포를 이해하는 데 도움이되는 도구입니다. 퍼브로 메이트 이온은 공명 하이브리드이며, 즉 실제 구조는 다중 가능한 구조의 평균입니다. 음전하는 4 개의 산소 원자 모두에 걸쳐 분비됩니다.