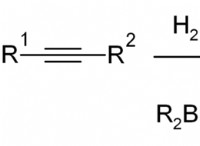* 극성 불일치 : 염화나트륨은 이온 성 화합물이며, 이는 양으로 하전 된 나트륨 이온 (Na+) 및 음으로 하전 된 염화물 이온 (Cl-)으로 구성되어 있습니다. 이들 이온은 정전기력을 통해 서로 끌어 당겨 결정 격자 구조를 형성한다. 반면에 비극성 용매는 상당한 전하 분리가없고 분자간 힘이 약합니다. 이 극성 불일치는 비극성 용매 분자가 NaCl에서 강한 이온 결합을 효과적으로 극복하는 것을 방지합니다.
* "처럼 녹는 것처럼": 화학의 일반적인 규칙은 "처럼 녹는 것처럼"입니다. 이것은 극성 물질이 극성 용매에 용해되고 비극성 물질이 비극성 용매에 용해 된 것을 의미합니다. NaCl은 매우 극성이므로 극성 용매에만 용해됩니다.
* 수화 : 물 (Polar Solvent)에서, 물 분자는 Na+ 및 클리온을 둘러싸고 수화 쉘을 형성한다. 이 수화 껍질은 이온 결합을 약화시키고 이온이 분리되어 용해되는 데 도움이됩니다. 비극성 용매는 이러한 수화 쉘을 형성하는 능력이 없으므로 이온이 결정 격자에서 벗어날 수 없습니다.
* 에너지 요구 사항 : NaCl이 비극성 용매에 용해 되려면, 용매 분자는 결정 격자에서 강한 이온 결합을 극복하기에 충분한 에너지를 제공해야 할 것이다. 비극성 용매는 이러한 결합을 효과적으로 파괴하기에 충분한 에너지를 가지고 있지 않습니다.
요약하면, 비극성 용매의 극성 부족, NaCl의 강한 이온 결합 및 수화 쉘의 부재는 NaCl이 이들 용매에 용해되는 것을 방지한다.