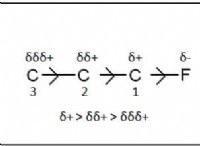
* 극성 : 물은 극성 분자입니다. 이것은 전자의 고르지 않은 공유로 인해 약간 양의 말단 (수소 원자)과 약간 음의 말단 (산소 원자)이 있음을 의미합니다. 반면에 탄소 테트라클로라이드는 비극성 분자입니다. 그것의 대칭 구조와 염소 원자의 전기성은 전자의 균일 한 분포를 초래한다.
* "처럼 녹는 것처럼": 화학의 일반적인 규칙은 "마치 녹는 것처럼"입니다. 극성 용매는 극성 용질을 용해시키고, 비극성 용매는 비극성 용질을 용해시킨다. 극성 용매 인 물은 수소 결합을 통해 다른 극성 분자와 효과적으로 상호 작용할 수 있습니다. 비극성 인 테트라 클로라이드는 물과의 강한 상호 작용을 형성 할 수 없습니다.
* 분자간 힘 : 물 분자는 서로 강한 수소 결합을 형성하여 응집력있는 네트워크를 만듭니다. 비극성 특성을 가진 탄소 테트라 클로라이드는 분자간 력이 약합니다 (런던 분산 힘). 분자간 힘의 이러한 차이는 두 물질이 균질 한 용액을 혼합하고 형성하는 것을 방지합니다.
요약 : 탄소 테트라 클로라이드 및 물의 비도성은 극성의 근본적인 차이와 분자가 유리하게 상호 작용할 수 없기 때문에 발생합니다. 대조 분자 상호 작용으로 인해 혼합 될 때 별개의 층으로 분리됩니다.