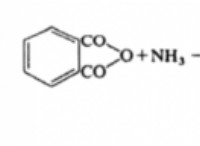
산화
* 정의 : 물질이 전자를 잃어 버려서 산화 상태가 증가하는 화학 공정.
* 메커니즘 : 산소 원자의 이득 또는 수소 원자의 손실을 포함합니다.
* 예 :
* 철의 녹음 :Fe + O₂ → Fe₂o₃ (철분은 전자를 잃고 산화됩니다)
* 연료 연소 :C + O₂ → CO₂ (탄소는 전자를 잃고 산화됩니다)
* 요원 : 산화제는 전자를 얻고 다른 물질에서 산화를 일으키는 물질입니다. 일반적인 예는 다음과 같습니다.
* 산소 (O ()
* 칼륨 과망간산산염 (kmno₄)
* 크롬산 (hiccro₄)
탈수 형성
* 정의 : 물질이 수소 원자를 잃는 화학 공정.
* 메커니즘 : 일반적으로 분자로부터의 수소 원자의 제거, 종종 촉매에 의해 포함된다.
* 예 :
* 에탄을 Ethene 로의 전환 :c₂h₆ → c₂h₄ + h₂ (에탄은 수소 원자를 잃고 탈수된다)
* 사이클로 헥산으로부터 벤젠 형성 :c₆h₁₂ → c₆h₆ + 3H₂ (사이클로 헥산은 수소 원자를 잃고 탈수된다)
* 요원 : 탈수 형성 제는 수소 원자의 제거를 촉진하는 물질이다. 이것들은 다음과 같습니다.
* 백금 (PT), 니켈 (NI) 또는 팔라듐 (PD)과 같은 촉매
* Quinones와 같은 특정 시약
주요 차이
* 초점 : 산화는 전자 손실에 초점을 맞추고, 탈수소화는 수소 손실에 중점을 둡니다.
* 메커니즘 : 산화는 산소 이득 또는 수소 손실을 포함 할 수있는 반면, 탈수 형성은 엄격하게 수소 손실을 포함한다.
* 결과 : 산화는 종종 산화물 형성을 초래하는 반면, 탈수 형성은 전형적으로 불포화 화합물의 형성을 초래한다.
요약 :
* 산화는 전자 손실을 포괄하는 더 넓은 개념입니다.
* 탈수 형성은 수소 원자 손실에 중점을 둔 특정 유형의 산화입니다.
탈수 소화는 산화의 한 유형이지만 모든 산화가 탈수 형성은 아닙니다.