이온화 에너지 란 무엇입니까?
이온화 에너지 , 이온화 전위 라고도합니다 ,주기적인 테이블의 모든 요소가 가진 속성입니다. 그렇다면 이온화 에너지의 정의는 무엇입니까? 이온을 형성하는 중성 원자에서 전자를 제거하는 데 필요한 에너지의 양입니다. 일반적으로 KJ/mol로 측정되며 측정은 기체상의 분리 된 원자를 기반으로합니다. 계산 방법, 첫 번째 및 두 번째 이온화 에너지의 의미, 주기율표에서의 트렌드를 배우겠습니다.
이온화 에너지는 방정식으로 표시 될 수 있습니다.
x + 첫 번째 이온화 에너지 → x + e
여기서
- x는 중성 원자입니다
- x는 단일 양전하 전하를 갖는 원자 X의 이온입니다
- e는 단일 음전하가있는 전자입니다
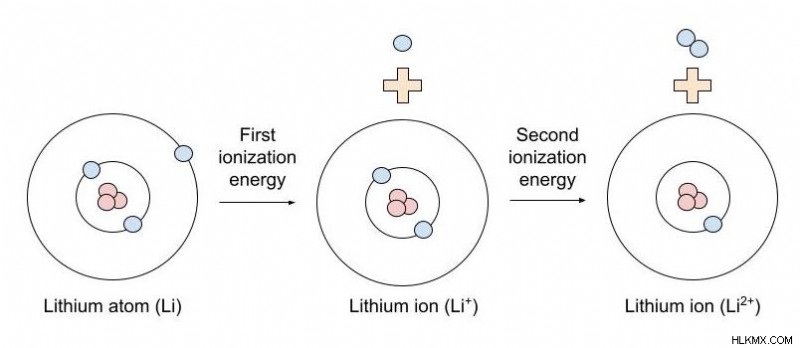
“첫 번째”이온화 에너지가 의미하는 것은 무엇입니까?
방정식에서, "제 1 이온화 에너지"는 중성 원자의 첫 번째 전자를 제거하는 데 필요한 이온화 에너지를 말해서 단일 양전하의 이온을 제공합니다. 제 2 이온화 에너지는 1+ 이온 (단일 양전하의 이온을 의미)에서 제 2 전자를 제거하는 데 필요한 에너지의 양이며, 2+ 전하의 이온을 제공합니다.
.
이온이란 무엇입니까?
이온은 양의 또는 음으로 하전 된 원자입니다. 양성자의 전자에 불평등 한 다수의 전자를 갖도록함으로써 전하를 얻는다. 예를 들어, Na로 작성된 나트륨 이온에는 11 개의 양성자와 10 개의 전자가 있습니다. 전자보다 양성자가 하나 더있어 이온을 양으로 하전합니다. 모든 원자 또는 이온에 대한 양성자 수는 항상 일정합니다 (양성자 수는 원자 수를 결정합니다).
이온화 에너지를 계산하는 방법
이온화 전위 수소 다음 방정식을 사용하여 계산할 수 있습니다.
e = hcr h (1/N), 여기서
- e는 전자의 에너지 (또는 전자를 제거하는 데 걸리는 에너지의 양, 이온화 에너지)
- h Planck의 상수 =6.626 * 10 JS (Joules * 초) 입니다
- c 빛의 속도 =3.00 * 10 m/s (미터/초)
- r h rydberg constant =1.097 * 10 m (1/meters) 입니다
- n은 전자의 주요 양자 수 (또는 에너지 수준)입니다.
상수의 값을 연결하면 방정식이 다음과 같습니다.
e =(2.18 * 10 j) (1/n)
여기에서 전자 에너지 수준의 값을 연결하여 제거하는 데 필요한 에너지의 양을 찾을 수 있습니다.
주기율표에서의 이온화 에너지 추세
주기율표의 이온화 에너지 추세의 경우, 우리는 항상 요소의 첫 번째 이온화 에너지를 언급하고 있다고 가정합니다. 일반적으로, (첫 번째) 이온화 에너지는 주기성 테이블의 오른쪽 상단 구석을 향해 증가하며, 헬륨은 이온화 에너지가 가장 높습니다. 우리가 그 기간과 그룹 트렌드로의 추세를 무너 뜨리기 전에,이 추세에 대한 주요 기여 요인에 대해 이야기합시다 :Octet Rule.
.옥트 규칙
옥트 규칙에 따르면, 원자는 8 개의 원자가 전자 세트를 갖기 위해 노력합니다. 이 구성은 원자에 대한 안정성을 가장 많이 제공하기 때문입니다. 그룹 18 고귀한 가스는 전자 옥셋을 가지므로 화학적으로 불활성 및 반응성이 발생합니다. 고귀한 가스 원자는 다른 원소와 반응하지 않습니다.
옥트 규칙은 주기율표에서 이온화 에너지의 경향과 어떤 관련이 있습니까? 원자가 옥틴을 갖기 위해 노력하기 때문에 각 원자의 이온화 에너지는 전자의 수에 따라 다릅니다. 이 관계를 이온화 에너지 기간 추세와 직접 보자.
기간 추세
일정 기간 동안 이온화 에너지가 증가합니다. 앞에서 언급했듯이, 원소는 원자가 전자의 완전한 낙지를 갖기 위해 노력합니다. 요소가 기간에 걸쳐 연속적으로 더 많은 전자를 가지고 있기 때문에 원자가 목표에 더 가까워지고 더 가까워집니다. 따라서, 전자를 제거하는 것은 점점 어려워지고, 이온화 에너지는 옥틴에 접근함에 따라 이온화 에너지가 증가합니다. 옥틴에서 멀리 떨어진 원자에서 전자를 제거하는 것은 매우 쉽습니다.
하나의 원자가 전자를 갖는 그룹 1 요소는 전자 옥셋을 갖기 위해 전자를 쉽게 잃게됩니다. 따라서, 그룹 1 요소는 이온화 에너지가 매우 낮습니다. 원자가없이 전자를 제거하는 데는 에너지가 거의 필요하지 않습니다.
스펙트럼의 반대쪽 끝에서, 그룹 17 요소는 매우 높은 이온화 에너지를 갖는다. 7 개의 원자가 전자가 있으면 Halogens가 gain 를 원하기 때문입니다. 옥셋을 형성하기위한 하나 이상의 전자. 전자를 잃어버린 것은 목표에서 멀어지게되므로 전자를 제거하는 데 훨씬 더 많은 에너지가 필요합니다.
그룹 트렌드
그룹 아래에서 이온화 에너지가 감소합니다. 이는 그룹을 내려 가면서 전자가 핵의 매력에서 멀리 떨어진 연속적으로 높은 에너지 수준에 위치하기 때문입니다. 또한, 그룹 아래로, 외부 원자가 전자와 핵 사이에 더 많은 전자가 있습니다. 이 중간 전자는 핵의 매력적인 힘의 외부 전자를“보호”하는 데 도움이됩니다. 따라서 그룹에서 더 낮은 전자에서 전자를 제거하는 것이 더 쉽습니다.
그래프의주기적인 테이블 트렌드

그래프에서 볼 수 있듯이 고귀한 가스는 가장 높은 이온화 에너지를 가지며 알칼리 금속은 가장 낮은 이온화 에너지를 갖습니다. 그룹 1과 18 사이에서 이온화 전위는 일반적으로 기간에 걸쳐 증가합니다.
추가 읽기
- 원자 반경 경향
- 원자
- 전기 음성 트렌드
- 주기적 트렌드가 쉽게 만들어졌습니다
- 주기적인 테이블을 읽는 방법