개념 이해
* 엔탈피 변화 (ΔH) : 이것은 반응 동안 열을 흡수하거나 방출합니다. 양성 ΔH는 반응이 흡열임을 의미합니다 (열을 흡수).
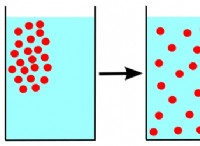
* 엔트로피 변경 (ΔS) : 이것은 시스템의 장애 또는 무작위성의 변화를 측정합니다. 양성 ΔS는 생성물이 반응물보다 더 장애가 있음을 의미합니다.
* 깁스 자유 에너지 (ΔG) : 이것은 반응의 자발성을 결정합니다. 음성 ΔG는 자발적 반응을 나타내고, 양성 ΔG는 비전자 반응을 나타냅니다.
방정식
이러한 요인들 사이의 관계는 Gibbs Free Energy 방정식에 의해 요약됩니다.
ΔG =ΔH- TΔS
어디:
* t는 켈빈의 온도입니다.
양성 ΔH 및 ΔS가 자발성을 유발할 수있는 방법
* 흡열 반응 : 양의 ΔH는 반응이 주변에서 열을 흡수한다는 것을 의미합니다. 이것은 낮은 온도에서 반응을 덜 유리하게 만듭니다.
* 장애 증가 : 양성 ΔS는 생성물이 반응물보다 더 장애가 있음을 의미합니다. 이것은 시스템의 무작위성을 증가시키면서 자발성을 선호합니다.
핵심 요소 :온도
* 고온 : 고온에서는 깁스 자유 에너지 방정식의 TΔS 항이 지배적이됩니다. TΔS가 양성 ΔH를 극복하기에 충분히 크면, 전체 ΔG는 음성이되어 반응을 자발적으로 만듭니다.
요약
양성 ΔH (흡열) 및 양성 ΔS (증가 된 장애)와의 화학 반응은 다음 조건에서 자발적 일 수 있습니다.
* 충분히 높은 온도 : 증가 된 엔트로피 용어 (TΔS)는 흡열 엔탈피 변화 (ΔH)를 능가하여 반응을 자발적으로 만듭니다.
예
얼음의 용융은 흡열 과정 (양성 ΔH)이며 장애의 증가 (양성 ΔS). 얼음 용융은 고온에 의해 구동되는 엔트로피의 증가가 공정의 흡열 특성을 극복하기 때문에 동결 지점 (0 ℃ 또는 273K) 이상의 온도에서 자발적이다.