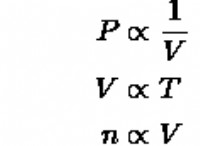NaCl (염화나트륨)
* 이온 결합 : NaCl은 이온 성 화합물이며, 이는 양으로 하전 된 나트륨 이온 (Na+)과 음으로 하전 된 클로라이드 이온 (Cl-) 사이의 정전기 인력에 의해 형성된다는 것을 의미한다.
* 강한 수화 : NaCl이 물에 용해되면 극성 물 분자는 이온을 둘러싸고 있습니다. 물 분자 (수소)의 양의 말단은 음으로 하전 된 클로라이드 이온에 끌리며, 물 분자 (산소)의 음성 말단은 양으로 하전 된 나트륨 이온에 끌린다. 수화라고하는이 과정은 이온을 효과적으로 당겨서 용액으로 분리시킵니다.
* 높은 용해도 : NaCl에서 비교적 약한 이온 결합과 결합 된 이온의 강한 수화는 높은 용해도를 초래한다.
Cao (산화 칼슘)
* 이온 결합 : CAO는 또한 칼슘 이온 (Ca2+) 및 산화물 이온 (O2-)을 갖는 이온 성 화합물이다. 그러나, 칼슘과 산소 사이의 결합은 NaCl의 결합보다 강하다.
* 제한된 수화 : 물 분자는 칼슘 이온을 수화시킬 수 있지만 산화물 이온은 반응성이 높다. CAO가 물과 반응 할 때, 그것은 강력한 발열 반응을 겪고, 수산화 칼슘 (Ca (OH) 2), 슬레이크 석회라고도합니다. 이 반응은 NaCl에서 발생하는 수화 과정보다 훨씬 더 중요합니다.
* 낮은 용해도 : CAO의 강한 이온 결합과 수산화 칼슘을 형성하기위한 물과의 빠른 반응은 물에 약간 용해됩니다.
요약 :
* NaCl은 이온 결합이 상대적으로 약하고 물 분자는 이온을 효과적으로 수화시키기 때문에 매우 가용성입니다.
* CAO는 강한 이온 성 결합과 물과의 빠른 반응으로 인해 약간 가용성이 있습니다.